Зачем нужны исследования и разработки в здравоохранении?
Исследования и разработки в области здравоохранения действительно важны для сектора здравоохранения. Они обеспечивают практикующих врачей и инвесторов системы здравоохранения инновациями и соответствующими доказательствами для профилактических мероприятий, эффективных методов лечения и схем ухода.
В данном экономическом обзоре мы даем обзор исследований и разработок в области здравоохранения и их роли в системе здравоохранения.
Что такое исследования и разработки в области здравоохранения?
Исследования и разработки - это выявление потребности или проблемы, генерирование идеи или решения, преобразование идеи в продукт или услугу, тестирование продукта или услуги на предмет эффективности, действенности и ценности, запуск продукта или услуги, продолжение мониторинга, оценки и совершенствования продукта или услуги, а затем окончательный вывод продукта или услуги из эксплуатации, когда он устаревает.
Как правило, к продуктам относятся медицинские приборы, лекарства и вакцины, решения для генной терапии, диагностические инструменты. Они также могут включать услуги и пути ухода, в том числе профилактику, лечение и уход, реабилитацию.
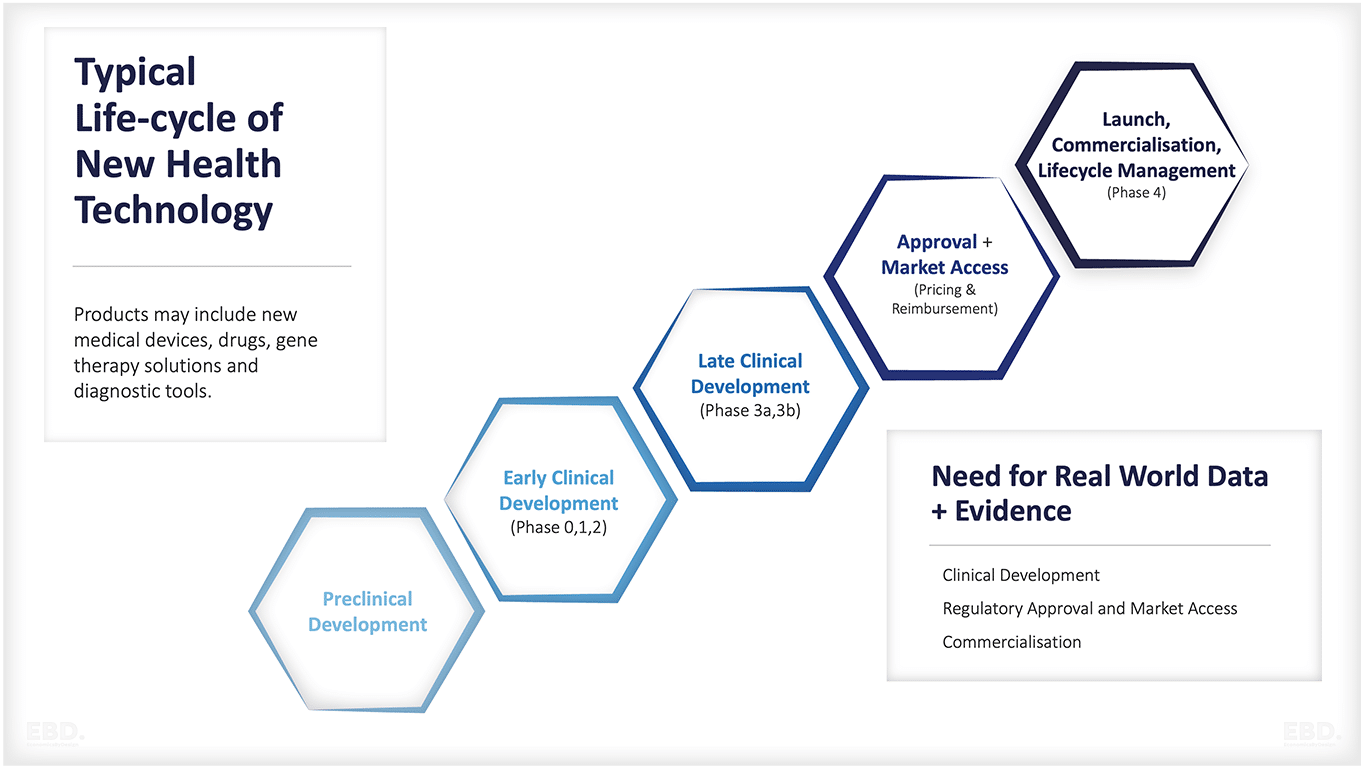
Основными этапами исследований и разработок в области здравоохранения являются:
Доклиническая разработка
Сюда входят все действия, которые происходят до того, как продукт или услуга будут испытаны на людях. Для клинических вмешательств, таких как лекарства, медицинские приборы, генная терапия, диагностические инструменты и т. д., это включает в себя проверку осуществимости, проверку безопасности и т. д., часто в лабораторных условиях.
Некоторые доклинические разработки проводятся с использованием животных. Испытания in vitro проводятся "вне тела" или "вне нормального биологического контекста", например в пробирке или чашке Петри. In vivo - это когда испытания проводятся "в живом организме", и в случае доклинических разработок это испытания на животных.
Часто доклинические разработки могут включать так называемые "обсервационные исследования". Это наблюдение за состоянием здоровья населения или подгруппы населения с целью выявления проблем, которые существуют, и профилактических и лечебных мероприятий, которые могут быть эффективными.
Ранняя клиническая разработка
На этом этапе испытания проводятся на людях. Обычно на этих ранних стадиях лекарство или устройство проверяется на безопасность или дозировку, а также на то, как клиническое вмешательство воздействует на человека. На этом этапе часто проводятся клинические испытания "стадий 0, 1 и 2", которые представляют собой научные исследования, проверяющие воздействие продукта или услуги на людей. Стадия испытания обычно отражает количество участников, которое увеличивается по мере получения новых сведений о дозировке, безопасности и побочных эффектах.
Поздняя клиническая разработка
На этом этапе происходит масштабное тестирование продукта или услуги на популяции. Эти испытания на третьей стадии являются сложными, длительными и зачастую дорогостоящими. Цель испытания - проверить влияние продукта или услуги на показатели здоровья.
Важно отделить воздействие продукта или услуги от других факторов, которые независимо объясняют изменения в показателях здоровья. По этим причинам клинические испытания третьей стадии часто проводятся как рандомизированные контролируемые исследования (РКИ).
РКИ предполагает случайное распределение участников исследования по различным группам, получающим вмешательство (группа лечения) и не получающим его (контрольная группа). Часто это делается "вслепую", так что участник фактически не знает, получает он вмешательство или нет. В случае с лекарственными препаратами они могут, например, получать "плацебо" (препарат, не имеющий терапевтической ценности).
Иногда исследование на стадии 3 может быть "двойным слепым", когда медицинский работник, осуществляющий вмешательство, не знает, кто из участников получает лечение, а кто - плацебо.
Если испытуемая популяция является репрезентативной по отношению к общей популяции или целевой популяции для лечения, то процесс РКИ может гарантировать, что все факторы, которые могут повлиять на результат лечения (такие как возраст, другие состояния здоровья, физическая форма и т.д.), с одинаковой вероятностью будут влиять на группу лечения и контрольную группу и поэтому могут быть проигнорированы. Единственной причиной различий в результатах лечения между группой лечения и контрольной группой является терапевтическая ценность продукта или услуги.
На практике проведение РКИ очень сложно и/или дорого, поэтому часто в испытаниях третьей стадии используются другие методы, позволяющие минимизировать риск так называемой "ошибки атрибуции", т.е. ошибочного приписывания наблюдаемых различий в исходах в группе лечения продукту или услуге.
Важно отметить, что если продукт или услуга требуют одобрения регулирующих органов, то клинические испытания третьей стадии обычно проводятся после подачи заявки на получение разрешения регулирующих органов, но до его получения.
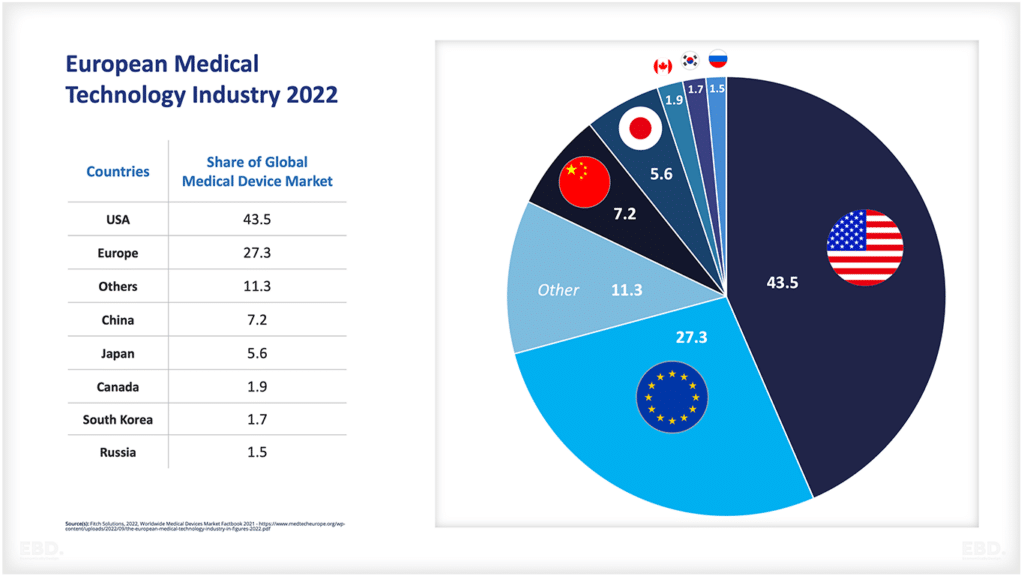
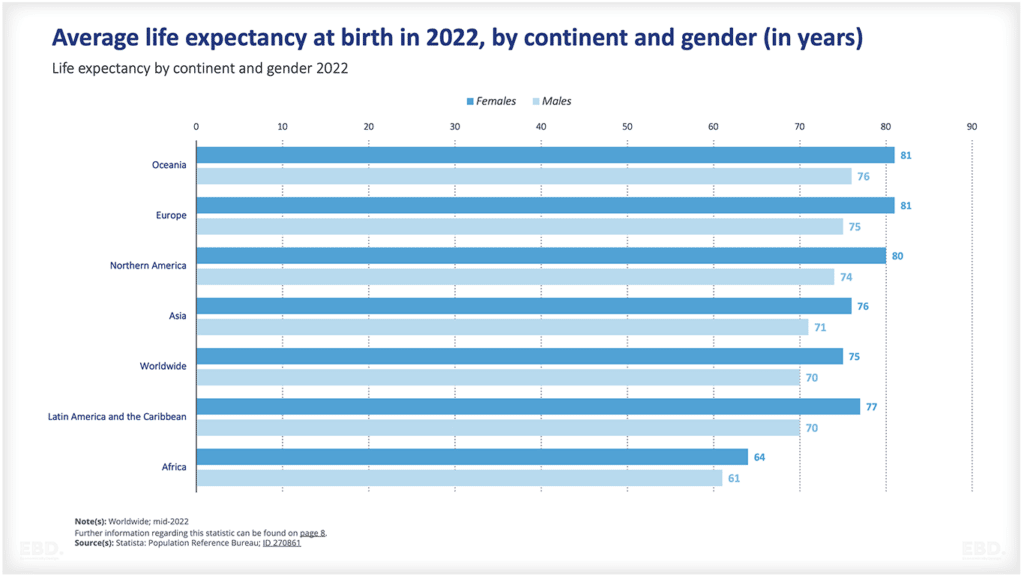
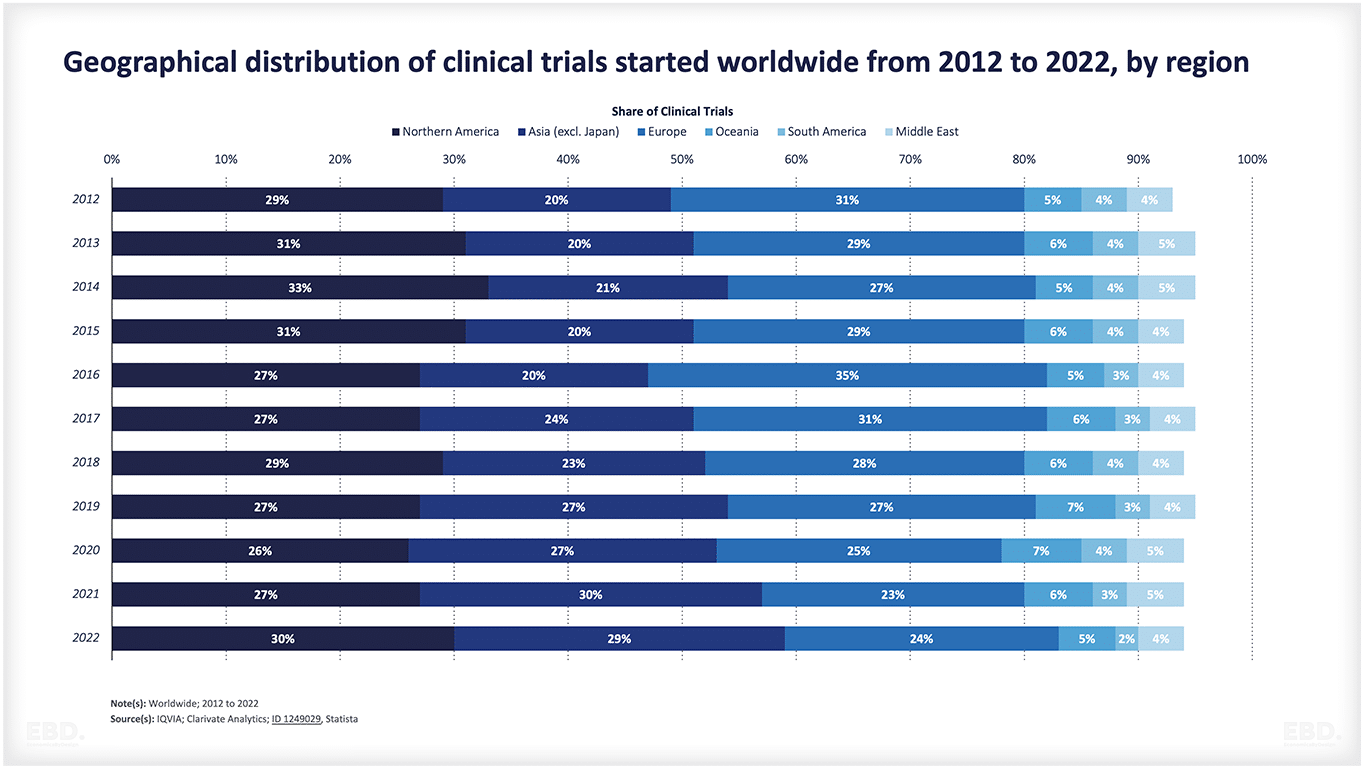
Из приведенной ниже диаграммы видно, что в настоящее время подавляющее большинство клинических исследований проводится в Северной Америке, Азии и Европе.
Разрешение на продажу, ценообразование и возмещение расходов
На этом этапе продукт или услуга утверждаются соответствующим регулирующим органом (если это необходимо) и принимаются решения о ценообразовании и возмещении расходов теми, кто отвечает за оплату или заказ медицинских услуг от имени населения.
На этом этапе часто требуется сбор дополнительной информации, в частности, экономических данных для демонстрации ценности продукта или услуги. Этот этап часто называют оценкой медицинских технологий (Health Technology Appraisal, HTA). Организации, разработавшей продукт или услугу, будет предложено представить данные для поддержки этого процесса, а плательщик поручит проведение HTA независимым экспертам.
Для некоторых плательщиков существуют четкие контрольные показатели или рекомендации, касающиеся эффективности и стоимости, которые должны быть достигнуты, чтобы продукт или услуга были включены в пакет медицинских услуг. Для других решение принимается в каждом конкретном случае. Часто решения о включении продуктов или услуг в пакет основных медицинских услуг принимаются по рекомендации специализированного комитета, в состав которого входят эксперты в данной области, а также представители пациентов.
Все чаще плательщики и регулирующие органы увязывают утверждение, ценообразование и возмещение расходов с требованием, чтобы продукт или услуга подвергались определенному дополнительному сбору данных и надзору для подтверждения эффективности и ценности.
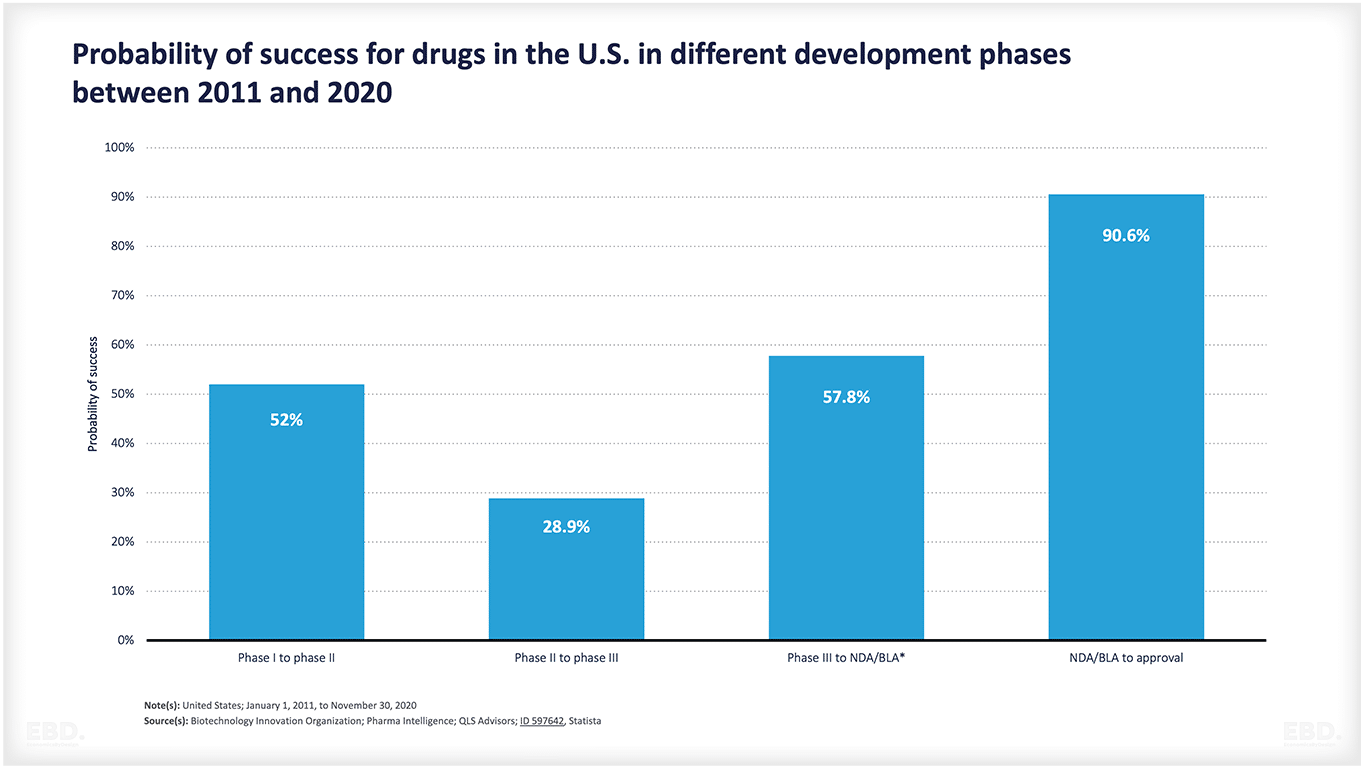
Как видно из приведенной ниже диаграммы, многие продукты не проходят путь от замысла до утверждения. Это связано со значительной научной или технологической неопределенностью. На этой диаграмме показано, что в США около половины препаратов переходят из первой стадии во вторую и около 29% из них - из второй в третью. Затем более половины препаратов переходят на стадию доступа к рынку, и если они попадают туда, то более 90% получают одобрение. Однако в целом только 7,8% препаратов проходят путь от доклинической стадии до одобрения. Это огромный объем ресурсов, направляемых на продукты, которые не доходят до коммерческого запуска.
Запуск, коммерциализация, управление жизненным циклом
Этот этап охватывает все исследования и разработки, связанные с медицинским продуктом или услугой после того, как они были приняты к внедрению среди населения. Эта деятельность включает в себя мониторинг безопасности и побочных эффектов, мониторинг воздействия, а также сбор реальных фактических данных для принятия решений о возможности расширения охвата населения продуктом или о типах заболеваний, при которых он может помочь.
Что такое реальные данные и свидетельства?
Заинтересованные стороны, занимающиеся исследованиями и разработками в системах здравоохранения, все чаще обращаются к использованию реальных данных и доказательств для обоснования решений. Данные реального мира - это данные, регулярно собираемые в системе здравоохранения и за ее пределами. Доказательства реального мира основаны на анализе данных реального мира.
Потенциальные возможности использования реальных данных и доказательств включают:
Клинические разработки
- Приоритет ранней клинической разработки
- Изучение заболевания и его бремени
- Изучить управление заболеванием
- Дизайн клинических испытаний
- Выполнение испытаний Повышение эффективности набора пациентов
Утверждение нормативных документов + доступ на рынок
- Облегчение процесса регулирования
- Содействие ценообразованию, возмещению расходов и доступу на рынок
Коммерциализация
- Предоставить новые научные и клинические данные
- Предоставление коммерческой и бизнес-информации
- Поддержка коммерческих программ
- Содействие постмаркетинговому фармаконадзору и наблюдению
- Оптимизация управления пациентами
- Расширение индикации
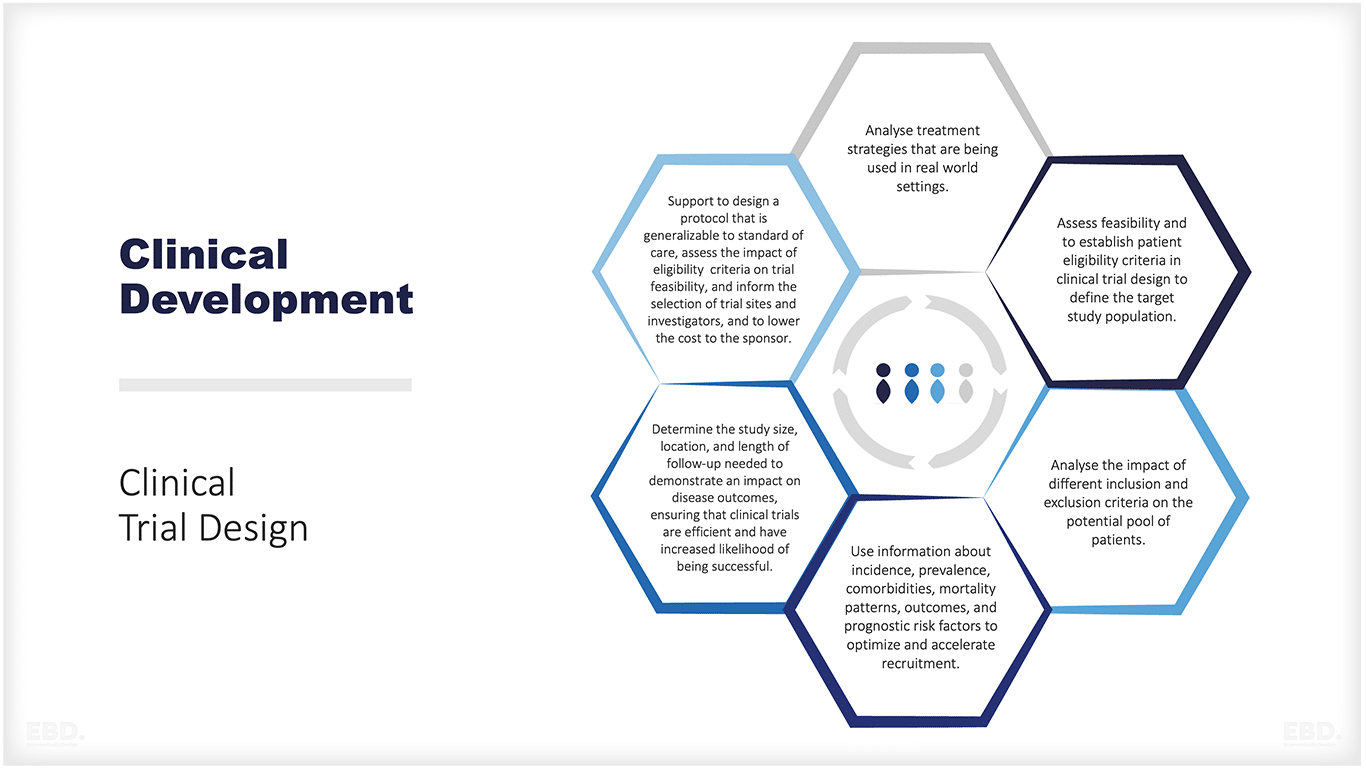
На рисунке ниже приведено краткое описание типов вопросов, по которым реальные данные могут помочь в разработке и проведении эффективного клинического испытания.
Характеристики идеального источника данных для получения реальных доказательств
- Популяция пациентов, репрезентативная для пациентов с основным заболеванием (например, демографические показатели, сопутствующие клинические заболевания)
- Перспективное планирование
- Постоянное обновление с минимальными затратами ресурсов
- Продольное наблюдение
- Богатая клиническая дата: введенная врачом, сообщенная пациентом и созданная пациентом
- Приняты меры по контролю качества
- Интеграция в существующие системы данных
При работе с реальными данными возникают определенные трудности. Эти данные могут быть разного качества с точки зрения точности, а также могут иметь неполный охват. Реальные данные не всегда являются регулярными и своевременными, а также могут не предоставлять исчерпывающей информации во всех интересующих областях. Однако по мере развития цифровых возможностей систем здравоохранения эти проблемы становятся все меньшим препятствием для использования реальных данных сообществом исследователей и разработчиков.
Что такое управление исследованиями?
Исследования и разработки в области здравоохранения сопряжены со многими этическими проблемами. Участников исследований просят стать подопытными кроликами для новых продуктов и услуг, которые могут не работать или, что еще хуже, навредить. Часто их просят принять участие в исследованиях, поскольку они уже живут с тем или иным заболеванием. Кроме того, их просят предоставить исследовательской группе очень личные данные и информацию.
Управление исследованиями определяется как положения, правила, принципы и стандарты, обеспечивающие и гарантирующие высокое качество исследований. Хорошо продуманное управление исследованиями должно обеспечивать уверенность всех заинтересованных сторон в том, что исследование проводится в соответствии с требуемыми стандартами качества, имеет цель и ценность, а также соблюдаются стандарты участия, защиты участников и исследователей и обмена информацией.
Управление исследованиями охватывает все исследования в области здравоохранения, в которых участвуют люди, их ткани или данные.
Механизмы управления исследованиями в разных странах различны. В некоторых странах действуют жесткие механизмы, и для всех исследований с участием людей, их тканей или данных требуется одобрение. Одобрение этики зависит от качества протокола исследования и наличия согласия участников.
В некоторых странах эти механизмы еще не созданы. Если исследования проводятся в странах, где отсутствует система управления исследованиями и/или не было получено этическое одобрение, исследователям может быть трудно добиться публикации своих исследований в рецензируемых журналах.
Полезными примерами механизмов и организаций управления исследованиями являются:
- Европейский регламент по клиническим исследованиям, который регулирует клинические исследования на уровне Европейской комиссии
- Управление по исследованиям в области здравоохранения NHS обеспечивает политическую основу для надлежащей практики управления и проведения исследований в области здравоохранения и социального обеспечения в Великобритании
- На сайте ClinRegs Национального института аллергии и инфекционных заболеваний США (NIAD) представлена информация о правилах проведения клинических исследований в отдельных странах мира.
Каков объем инвестиций в исследования и разработки в области здравоохранения?
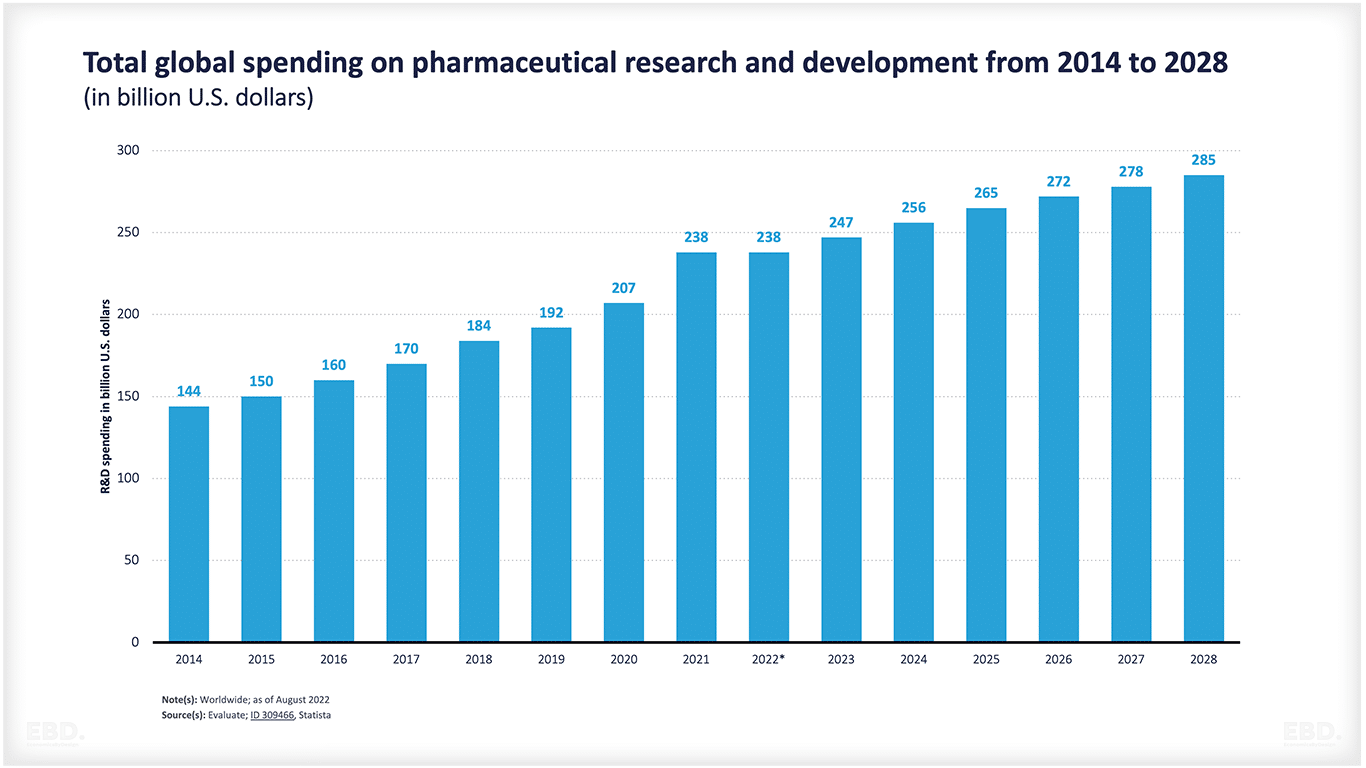
По данным Института статистики ЮНЕСКО , в 2022 г. на исследования и разработки в мире было израсходовано 2,47 млрд. долл. из них 238 млрд. долл. приходится на исследования и разработки в области фармацевтики, и ожидается, что к 2028 г. этот показатель вырастет до 285 млрд. долл.
В финансировании исследований и разработок участвует множество заинтересованных сторон, включая частные компании (например, фармацевтические, компании, производящие медицинское оборудование, компании, занимающиеся цифровым здравоохранением), государство, предоставляющее гранты и премии, проводящее исследования в государственных медицинских учреждениях, а также благотворительные организации, занимающиеся медицинскими исследованиями.
Примерами ведущих мировых фармацевтических компаний, инвестирующих в исследования и разработки, являются:
К числу ведущих филантропических организаций, финансирующих исследования в области здравоохранения, во всем мире относятся:
- Wellcome Trust
- Медицинский институт Говарда Хьюза
- Фонд Билла и Мелинды Гейтс
- Институт Пастера
- Фонд Освальдо Круза
- Фонд Рокфеллера
Кто осуществляет научные исследования и разработки в области здравоохранения?
Большинство исследований и разработок в области здравоохранения проводится учеными-клиницистами, клиницистами, финансирующими исследования, и академическими медицинскими учреждениями, принимающими исследования.
Академические научные центры здравоохранения - это медицинские учреждения, сочетающие научные исследования, образование и предоставление услуг. Примерами являются:
- Джона Хопкинса (Школа общественного здравоохранения, Школа сестринского дела, Школа медицины) в США
- Партнеры UCL вАнглии
- Госпиталь мозга Нпистанбулв Турции
- Медицинский центр Лейденского университета в Нидерландах
Какова ценность исследований и разработок в области здравоохранения, финансируемых государством?
Правительства финансируют исследования и разработки в области здравоохранения для стимулирования инвестиций со стороны благотворительного и коммерческого секторов, а также для обеспечения доступа к средствам в тех областях, где коммерческие стимулы относительно слабы.
Таким образом, финансируемые государством исследования и разработки в области здравоохранения могут принести пользу как за счет стимулирования экономического роста, так и за счет улучшения здоровья населения и отдельных людей.
Имеется очень мало исследований, показывающих отдачу от инвестиций в государственное финансирование НИОКР, однако некоторые исследования показали положительную отдачу в отдельных случаях.
- Grant J, Buxton MJ Экономическая отдача от финансирования медицинских исследований BMJ Open 2018;8:e022131. doi: 10.1136/bmjopen-2018-022131 показала отдачу от 7% до 10% в виде прироста здоровья и еще 15% за счет более широкого экономического эффекта. Эти данные были получены на основе инвестиций в исследования сердечно-сосудистой системы, рака и опорно-двигательного аппарата в Великобритании.
- Джойс Крейг и ее коллеги из Университета Йорка оценили рентабельность инвестиций в финансирование центров биомедицинских исследований в Великобритании примерно в 29%.
- Недавнее исследование , проведенное консорциумом Kings College London, RAND Europe и Brunel University, показало, что окупаемость инвестиций составляет около 25% (на основе исследований заболеваний опорно-двигательного аппарата в Великобритании).
Наиболее важным фактором, который необходимо учитывать при оценке инвестиционной стоимости исследований и разработок в здравоохранении, является то, что они по своей сути являются неопределенными. Именно поэтому системы здравоохранения должны быть готовы идти на риск и/или поддерживать компании, которые готовы идти на риск.
Глобальная обсерватория по НИОКР в области здравоохранения
Одним из лучших источников информации о глобальных исследованиях и разработках в области здравоохранения является Глобальная обсерватория по НИОКР в области здравоохранения Всемирной организации здравоохранения. Она предоставляет информацию и анализ, основанные на обобщении данных и информации из разных стран мира о научных исследованиях и разработках в области заболеваний.
Это действительно богатый ресурс для всех, кто хочет узнать, что изучается и где существуют пробелы. Это универсальный ресурс для исследователей в данной области.