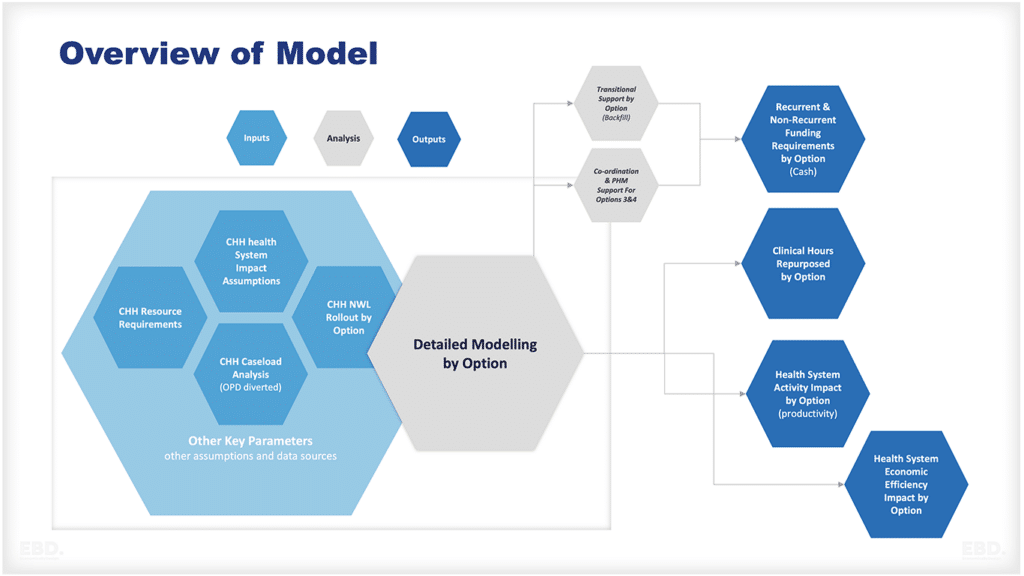
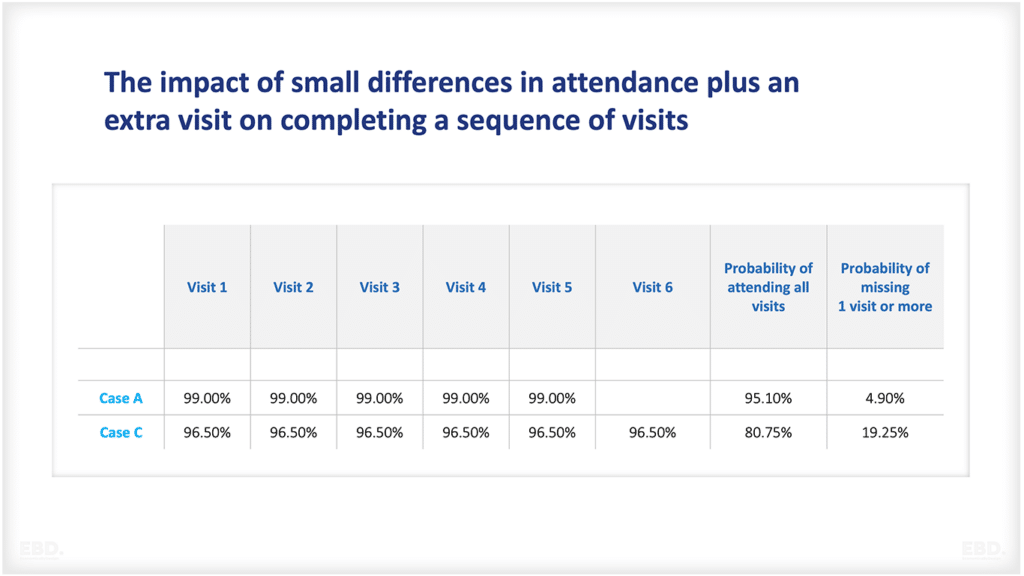
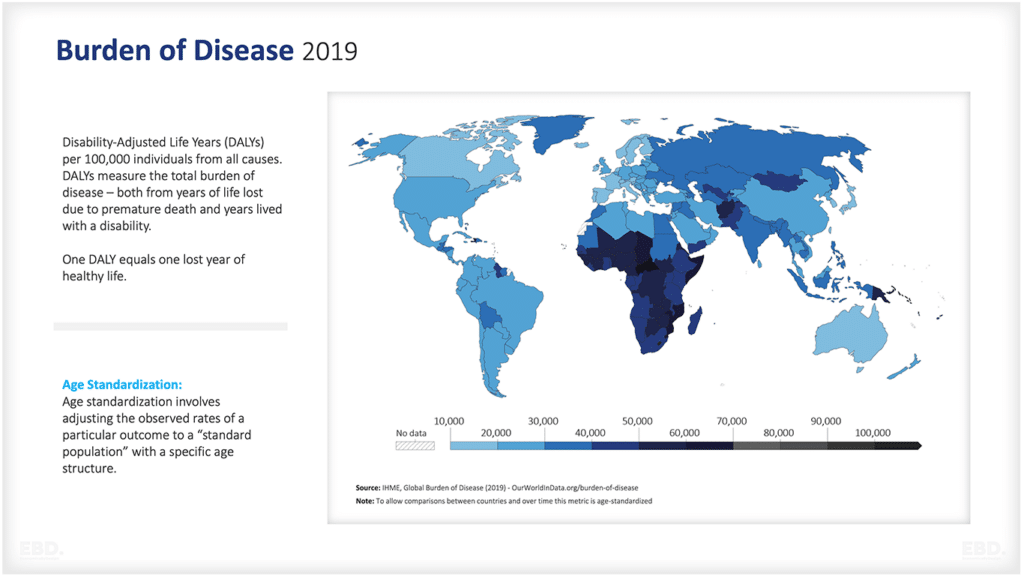
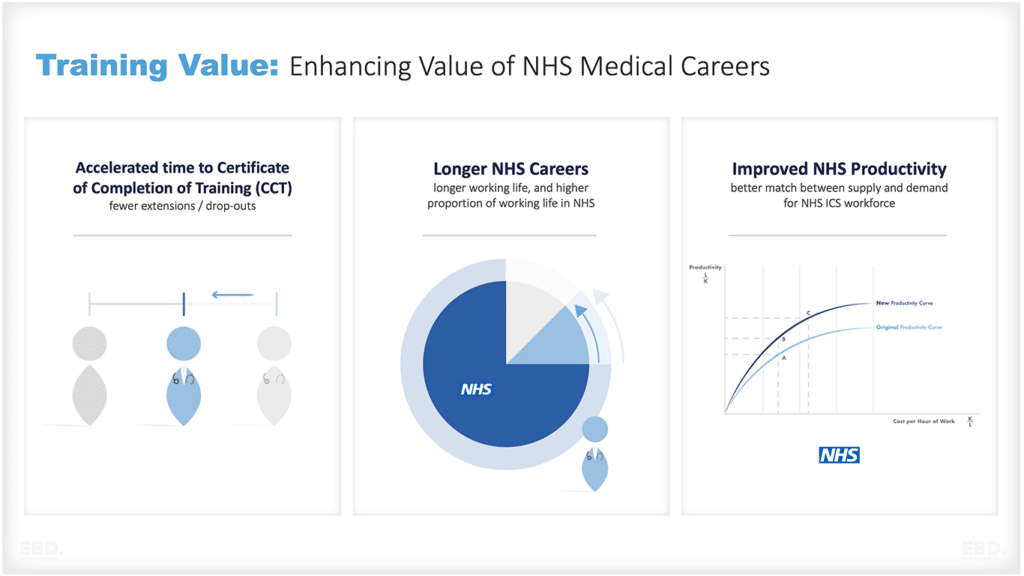
なぜ、医療に研究開発が必要なのか?
医療研究開発は、医療部門にとって本当に重要です。臨床医や医療システムの投資家に、予防介入、効果的な治療法、ケアパスに関するイノベーションと関連するエビデンスを提供するものです。
この経済レンズでは、医療研究開発の概要と、医療システムにおけるその役割について説明します。
Health Research And Developmentとは?
研究開発の基本は、ニーズや問題を特定し、アイデアやソリューションを生み出し、そのアイデアを製品やサービスに変換し、製品やサービスの有効性、効果、価値をテストし、製品やサービスを発売し、製品やサービスを監視、評価、改善し続け、そして最後に製品またはサービスが陳腐化したときにサンセットすることにあります。
一般的に、製品には医療機器、医薬品、ワクチン、遺伝子治療ソリューション、診断ツールなどが含まれます。また、予防、治療、ケア、リハビリテーションなどのサービスやケアパスも含まれることがあります。
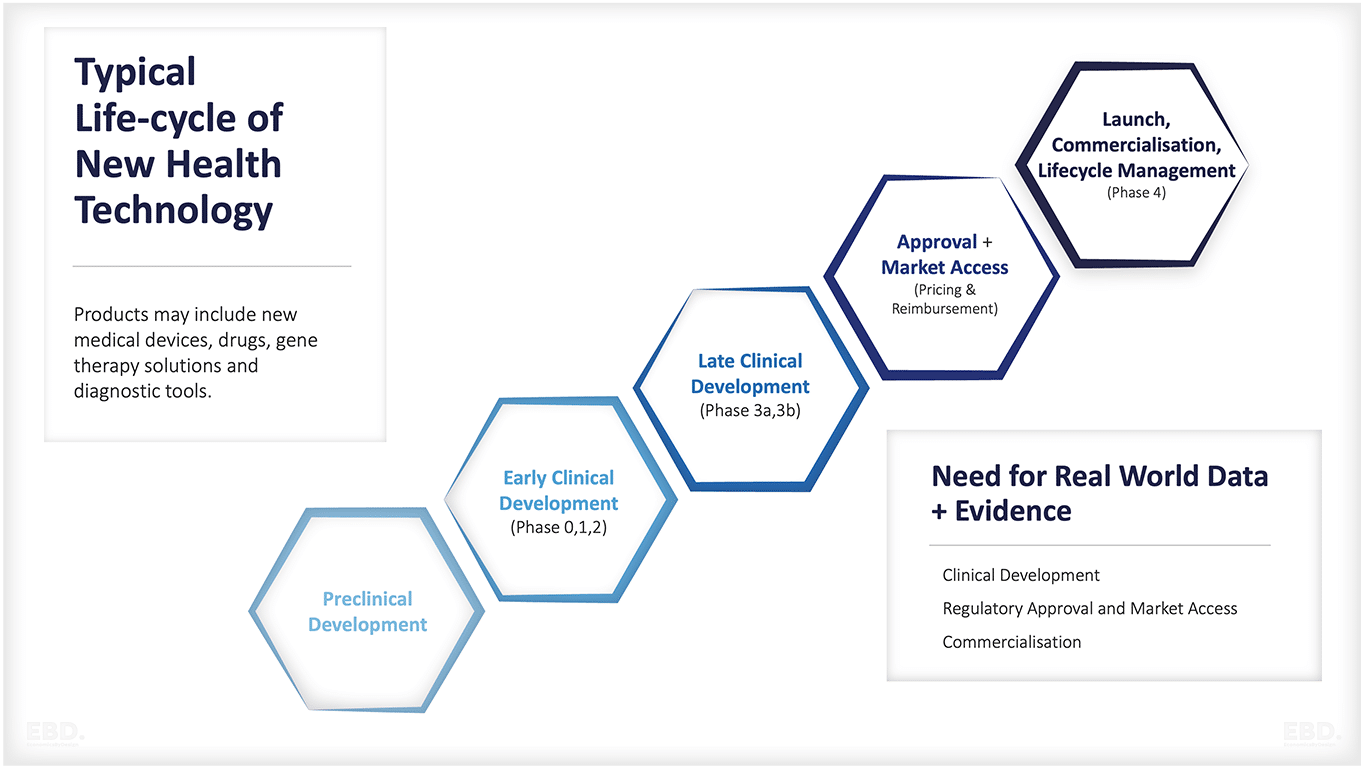
健康の研究開発の主要な段階は、次のとおりです:
前臨床開発
これは、製品やサービスが人々に対してテストされる前に行われるすべての活動をカバーする。医薬品、医療機器、遺伝子治療、診断ツールなどの臨床介入については、多くの場合、実験室での実現可能性試験、安全性試験などが含まれる。
一部の前臨床開発は動物を用いて行われる。試験管やシャーレの中など、「体外」または「通常の生物学的背景の外」で行われるのが試験管内試験である。In vivoとは、"生体内 "での試験であり、前臨床開発の場合は動物試験となる。
前臨床試験には、「観察研究」と呼ばれるものが含まれることがよくあります。これは、ある集団または集団のサブグループの健康状態をモニターして、どこに問題が存在し、どこに予防や治療の介入が有効であるかを特定するものです。
初期臨床開発
これは、人を使った試験が行われる場合です。通常、このような初期段階では、医薬品や機器の安全性や用法・用量が試験され、臨床介入が人間にどのような影響を与えるかが確認されます。この段階には、「ステージ0、1、2」の臨床試験が含まれることが多く、これは製品やサービスが人に与える影響をテストする研究調査である。臨床試験の段階は、一般的に参加者の数を反映し、用法、安全性、副作用についてより多くのことが判明するにつれて増加します。
臨床開発後期
これは、製品またはサービスが集団で大規模にテストされる段階です。このステージ3の試験は、複雑で時間がかかり、しばしば費用がかかる。この試験は、製品やサービスが健康上のアウトカムに与える影響を検証することを目的としています。
製品またはサービスの影響を、健康状態の変化を独立して説明する他の要因から切り離すことが重要である。このような理由から、ステージ3の臨床試験は、ランダム化比較試験(RCT)としてデザインされることが多い。
RCTでは、試験参加者を無作為に、介入を受けるグループ(治療グループ)と受けないグループ(コントロールグループ)に振り分けます。多くの場合、これは「ブラインド」で行われ、参加者は自分が介入を受けているかどうかを実際に知ることはありません。薬の場合は、例えば「プラセボ」(治療価値のない治療薬)を投与することもあります。
ステージ3の試験では、介入を行う医療従事者が、どの参加者が治療を受けているか、あるいはプラセボを受けているかを知らない「二重盲検」となることもある。
試験集団が一般集団または治療の対象集団を代表するものであれば、RCTプロセスにより、健康結果に影響を与える可能性のあるすべての要因(年齢、他の健康状態、体力など)が、治療群と対照群に等しく干渉する可能性があり、したがって無視できることが保証されます。治療群と対照群の間で健康結果が異なる唯一の理由は、製品またはサービスの治療価値である。
実際には、RCTを計画するのは非常に難しく、費用もかかるため、ステージ3の試験では、「帰属バイアス」と呼ばれる、治療群で観察された結果の差が誤って製品やサービスに起因するリスクを最小化するための他の手法が用いられることが多い。
重要なことは、製品やサービスに薬事承認が必要な場合、ステージ3の臨床試験は通常、薬事承認申請後、承認が下りる前に実施されるということです。
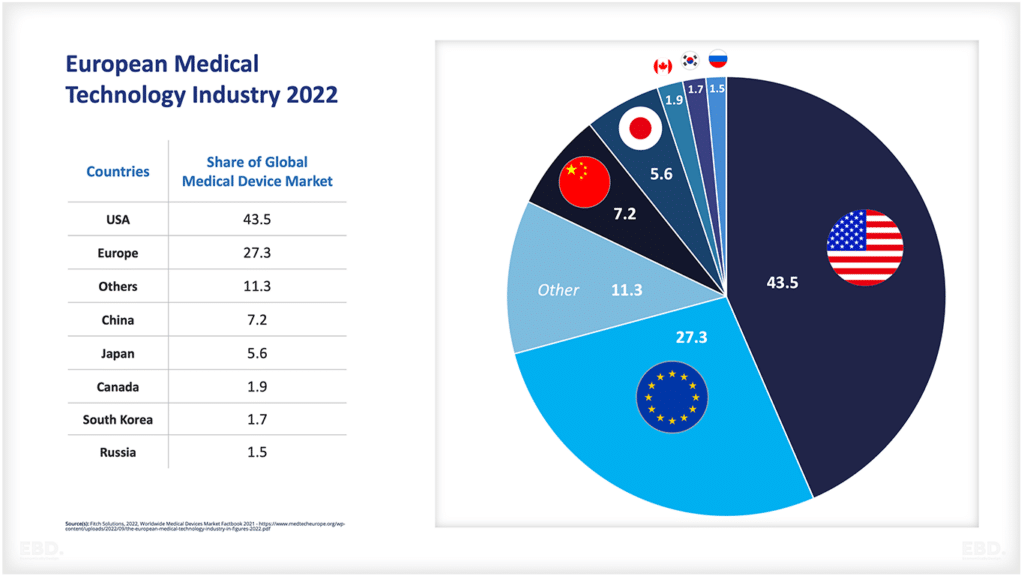
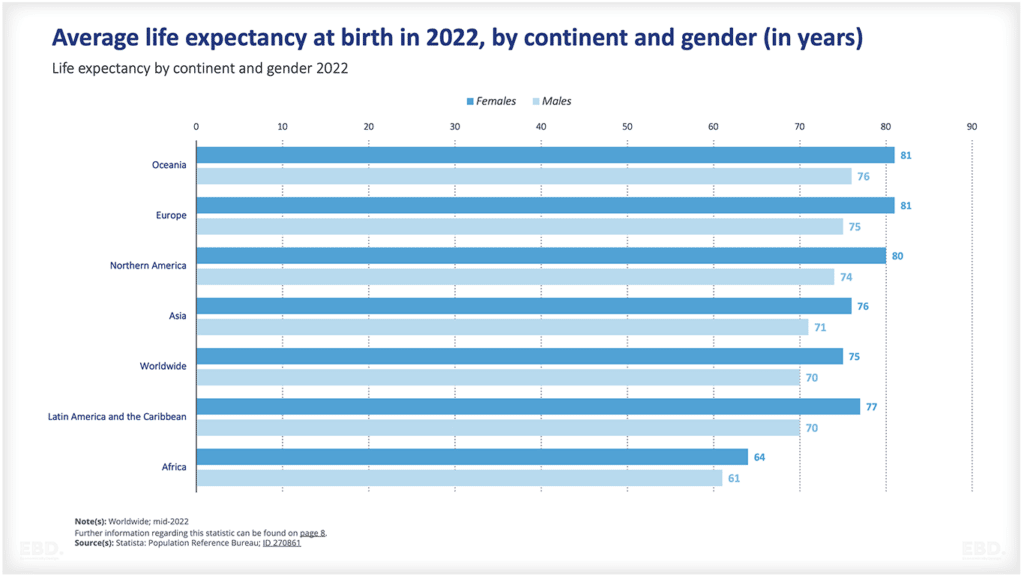
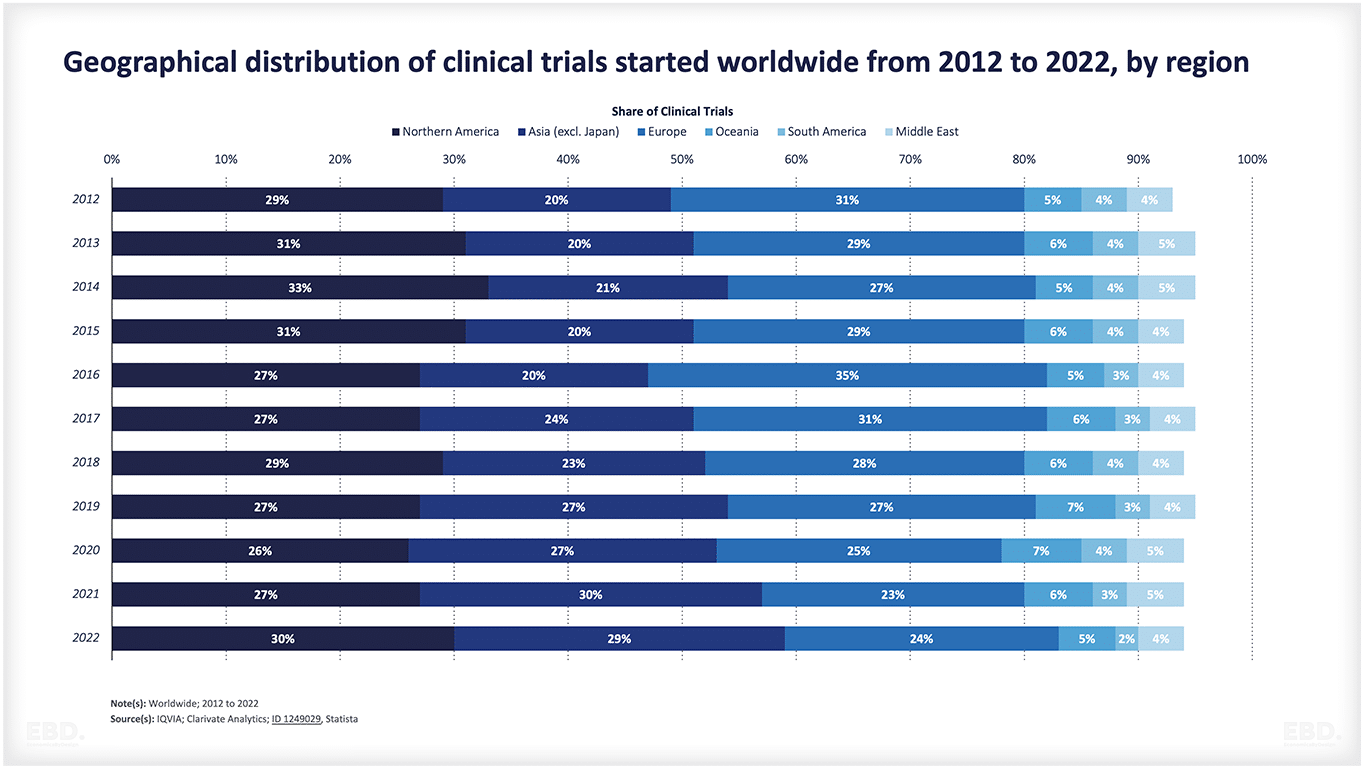
下図を見ると、現在、臨床試験の大半は、北米、アジア、欧州で行われていることがわかります。
市場認可、価格設定、保険償還
この段階では、製品またはサービスが関連する規制機関(必要な場合)によって承認され、集団に代わって医療費を支払う、または医療を委託する 責任者との間で、価格設定と償還の決定が行われることになります。
この段階では、追加情報の収集、特に製品やサービスの価値を証明するための経済データの収集が必要となることが多い。これは、医療技術評価(HTA)と呼ばれることが多い。製品またはサービスを開発した組織は、このプロセスをサポートするためのデータを提出するよう求められ、支払者は独立した専門家にHTAの実施を依頼することになります。
一部の支払者は、製品やサービスを医療 給付パッケージに含める場合、有効性と価値に関する明確なベンチマークやガイドラインがあり、それを達成する必要がある。また、ケースバイケースで決定される場合もある。多くの場合、製品やサービスを必須医療給付の一部として含めるかどうかは、その分野の専門家や患者代表からなる専門委員会の助言に基づいて決定されます。
ますます、支払者や規制当局が、製品やサービスの承認、価格設定、払い戻しを、有効性と価値を保証するためのデータ収集やサーベイランスの追加要件と関連付けるようになってきています。
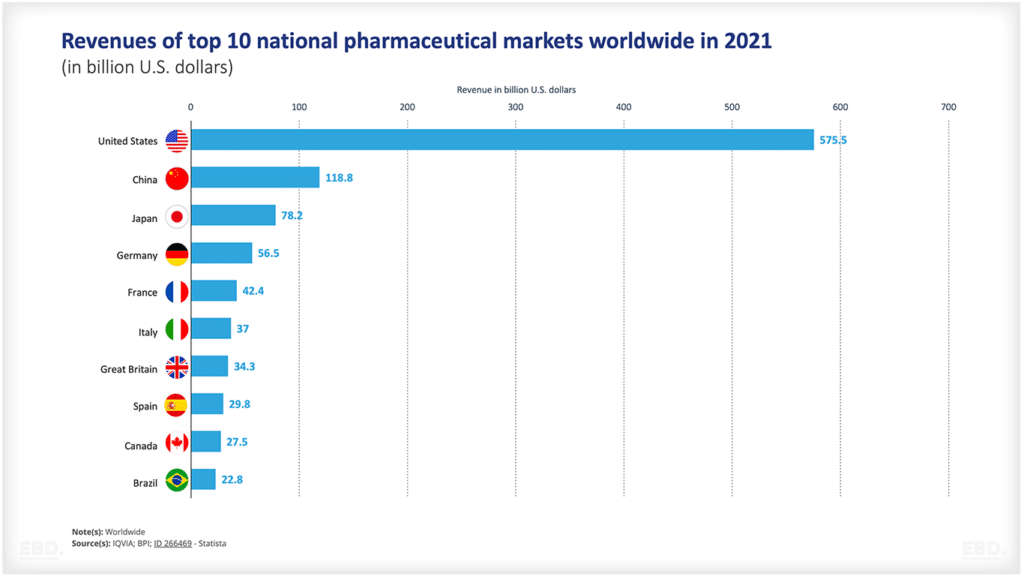
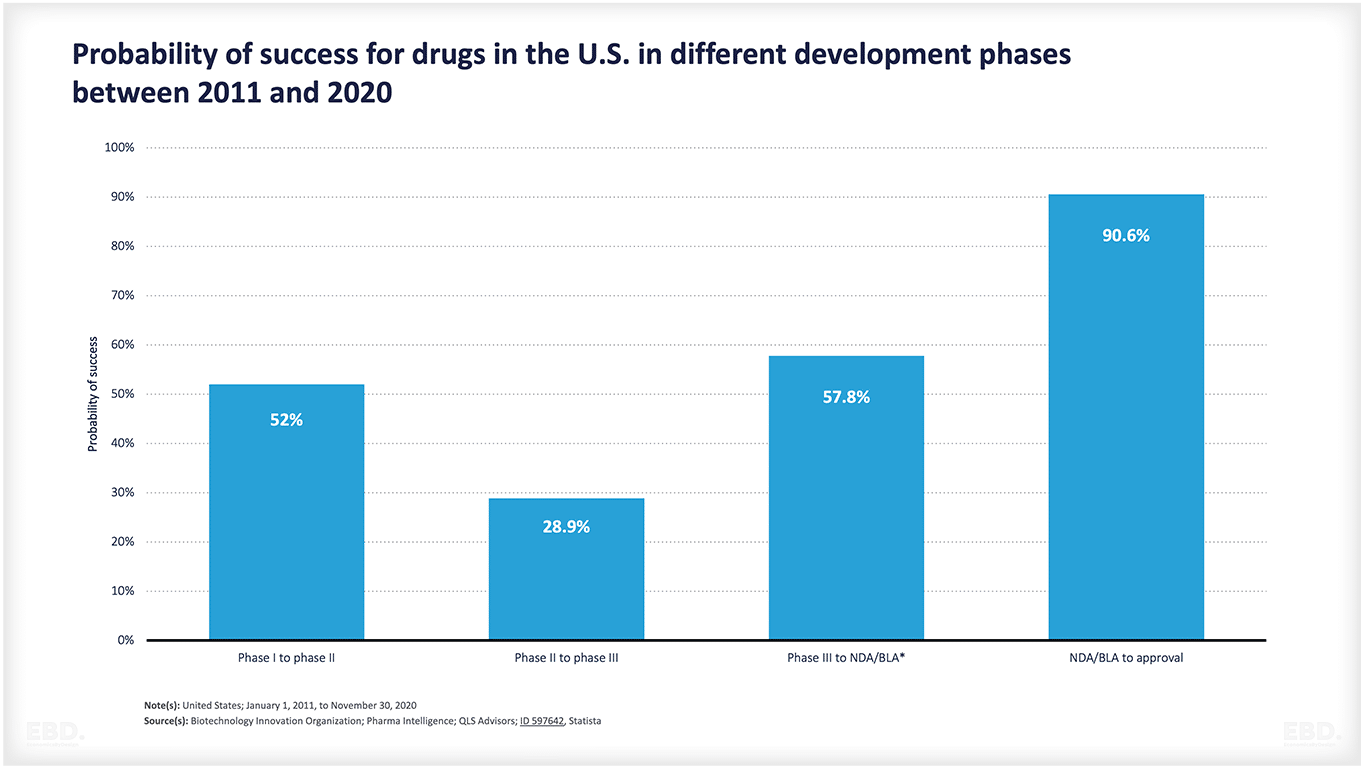
下のグラフが示すように、多くの製品が構想から承認まで至らない。そこには科学的、技術的な不確実性が多く含まれています。このグラフによると、アメリカの医薬品は、約半数がステージ1からステージ2へ、約29%がステージ2からステージ3へ移行しています。そして、半数以上が市場アクセスの段階に進み、市場アクセスに至れば90%以上が承認される。しかし、前臨床から承認に至る医薬品は全体の7.8%にすぎません。市販に至らない製品に膨大なリソースが割かれていることになります。
打ち上げ、商業化、ライフサイクルマネジメント
このフェーズでは、健康製品やサービスが集団に展開するために採用された後の研究開発活動全般が対象となります。ここでは、安全性や副作用のモニタリング、影響のモニタリング、さらに、その製品が対象人口を拡大するかどうかや、どのような健康状態に効果があるのかについての判断材料となる実世界のエビデンスを収集するなどの活動が行われます。
リアルワールドデータとエビデンスとは?
医療システムの研究開発関係者は、意思決定に際して、実世界のデータやエビデンスを活用することにますます注目しています。リアルワールドデータとは、医療システム内やそれ以外から日常的に収集されるデータのことです。リアルワールド・エビデンスは、リアルワールド・データの分析に基づくものです。
リアルワールドのデータやエビデンスの活用方法として、以下のようなものが考えられます:
臨床開発
- 早期臨床開発の優先順位
- 病気とその負担を研究する
- 病気を調べるために 管理
- クリニカル・トライアル・デザイン
- 試験実施 患者募集の効率化
規制当局の承認+市場参入
- レギュラトリープロセスを円滑にする
- 価格設定、償還、市場アクセスの円滑化
商品化
- 科学的・臨床的な新しい知見を提供する
- コマーシャルおよびビジネスインサイトの提供
- CM番組のサポート
- 市販後のファーマコビジランスとサーベイランスの円滑化
- 患者管理の最適化
- 表示拡大
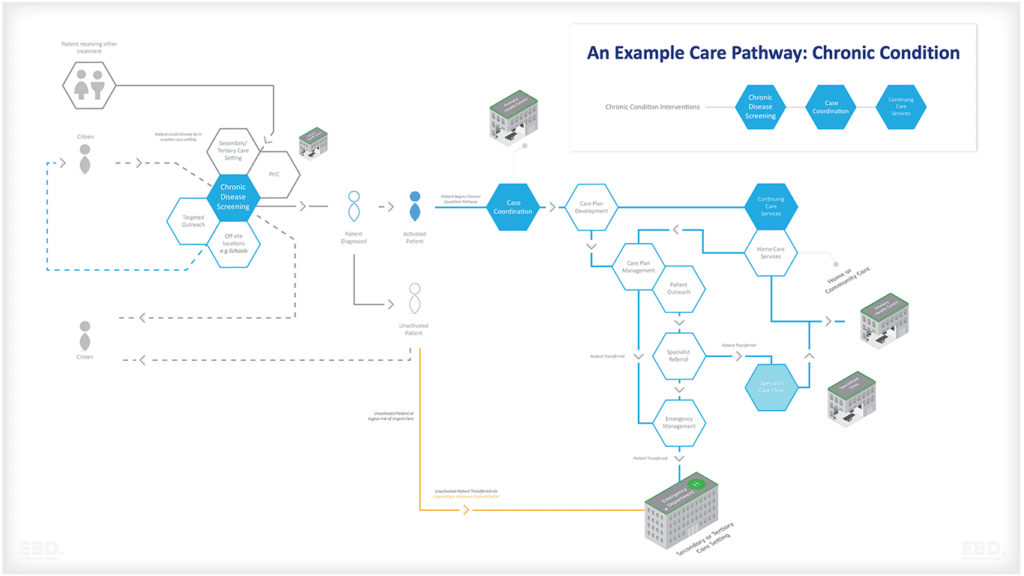
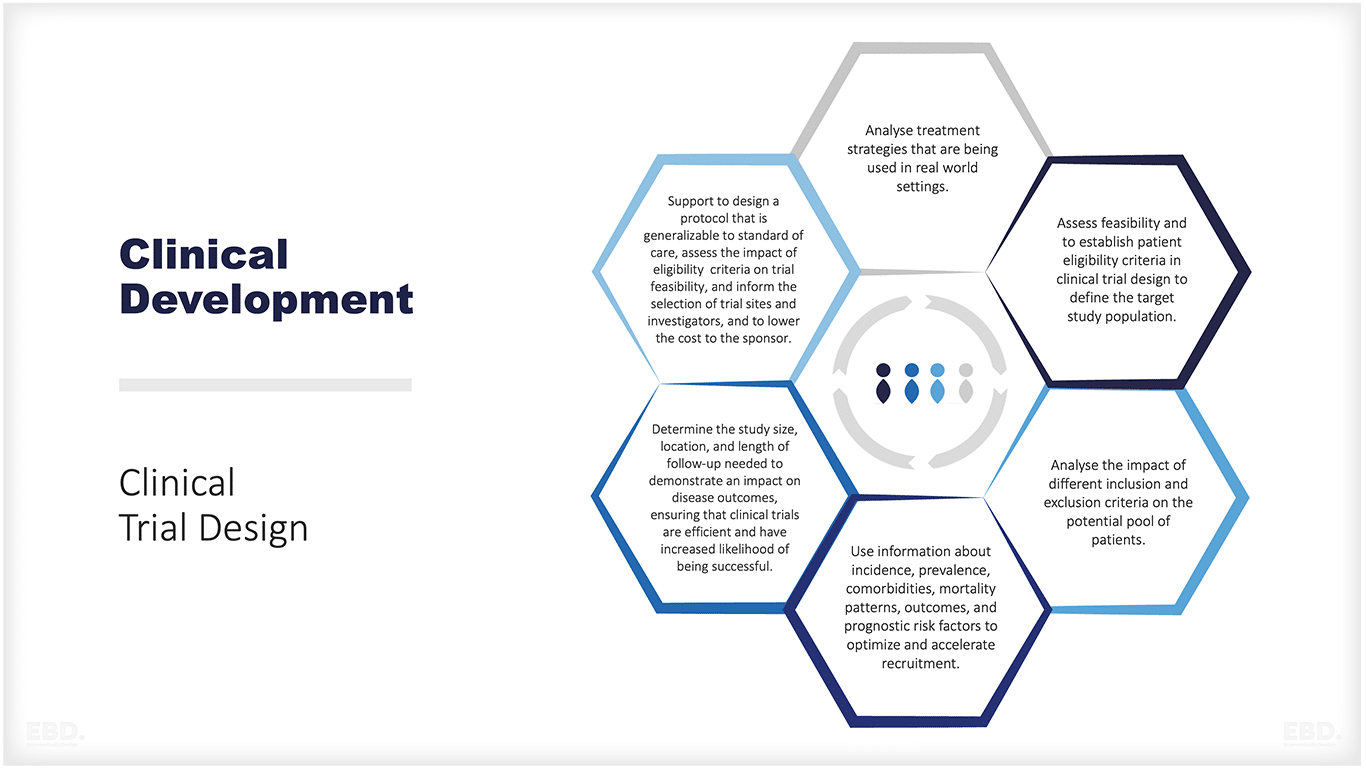
下図は、リアルワールドデータが効果的な臨床試験の設計と実施をサポートすることができる問題の種類をまとめたものである。
実世界のエビデンスを生み出すための理想的なデータソースの特徴
- 基礎疾患を持つ患者を代表する患者集団(例:人口統計、臨床的併存疾患)。
- プロスペクティブ・プランニング(Prospectively Planned
- 最小限のリソースで継続的な更新が可能
- 縦断的なフォローアップ
- 豊富な臨床日:臨床医が入力したもの、患者が報告したもの、患者が作成したもの
- 品質管理対策がなされている
- 既存のデータシステム内に統合
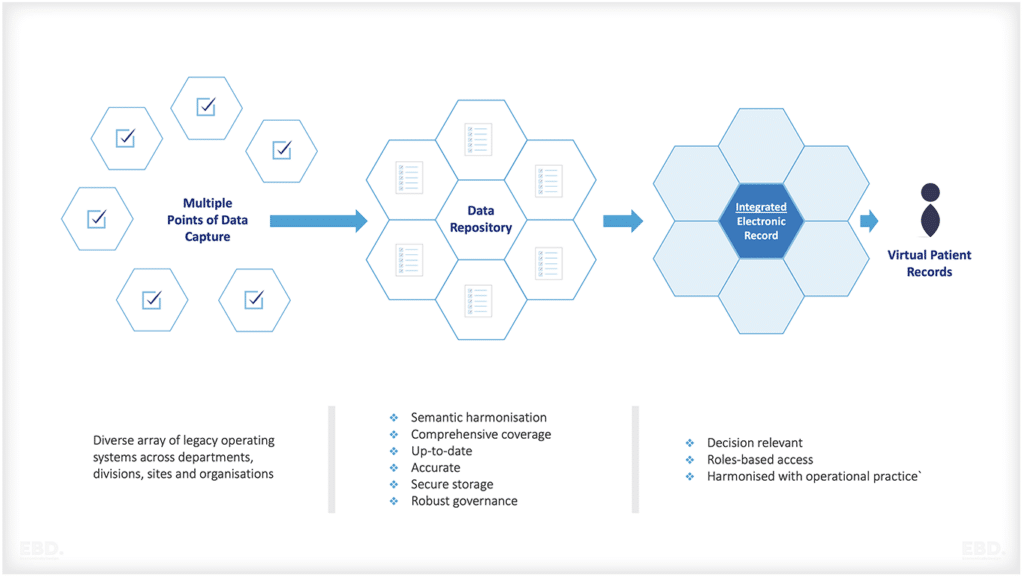
実世界のデータには課題があります。これらのデータは、正確さという点で品質が変化し、また、カバー範囲が部分的である可能性があります。実世界のデータは必ずしも定期的またはタイムリーではなく、すべての関心領域にわたる包括的な情報を提供しない可能性もあります。しかし、医療システムのデジタル機能が成熟するにつれて、これらの問題は、研究開発コミュニティが実世界のエビデンスを使用する際の障害ではなくなりつつあります。
リサーチガバナンスとは何か?
医療における研究開発には、多くの倫理的問題があります。研究参加者は、効かないかもしれない、あるいはもっと悪いことに害を及ぼすかもしれない新製品やサービスの人体実験台となるよう求められています。研究参加者は、すでにある症状や病気と共存しているため、参加するよう求められることが多いのです。また、非常に個人的なデータや情報を研究チームに提供するよう求められることもあります。
研究ガバナンスとは、質の高い研究を確保し保証するための規制、規則、原則、標準と定義される。よく設計された研究ガバナンスは、研究が必要な品質基準で行われていること、目的と価値があること、参加、参加者と研究者の保護、情報の共有に関する基準が遵守されていることを、すべての利害関係者に保証する必要があります。
また、研究ガバナンスは、人、その組織、またはそのデータに関わるすべての医療関連研究を対象とし、その成果をモニタリングし、医療における優れた実践を共有することを可能にしなければならない。
研究ガバナンスの仕組みは、世界各地で様々です。一部の国では、強力な取り決めがあり、人、その組織、またはそのデータを含むすべての研究に承認が必要である。倫理承認は、研究プロトコルの質、および参加者の同意が整備されていることが条件となる。
国によっては、このような取り決めがまだ確立されていない場合もあります。リサーチガバナンスが確立されていない国や、倫理的承認が得られなかった国で研究が行われた場合、研究者が自分の研究を査読付きジャーナルに掲載することは困難な場合があります。
研究ガバナンスの仕組みや組織の有用な例として、以下のようなものがあります:
- 欧州委員会全体で臨床試験を規定する「欧州臨床試験規則」について
- NHS Health Research Authorityは、英国における医療・社会福祉研究の管理・実施における優れた実践のための政策的枠組みを提供します。
- 米国国立アレルギー感染症研究所(NIAD)のウェブサイト「ClinRegs 」では、世界の特定国の臨床研究規制に関する国別の情報を提供しています。
健康研究開発への投資額は?
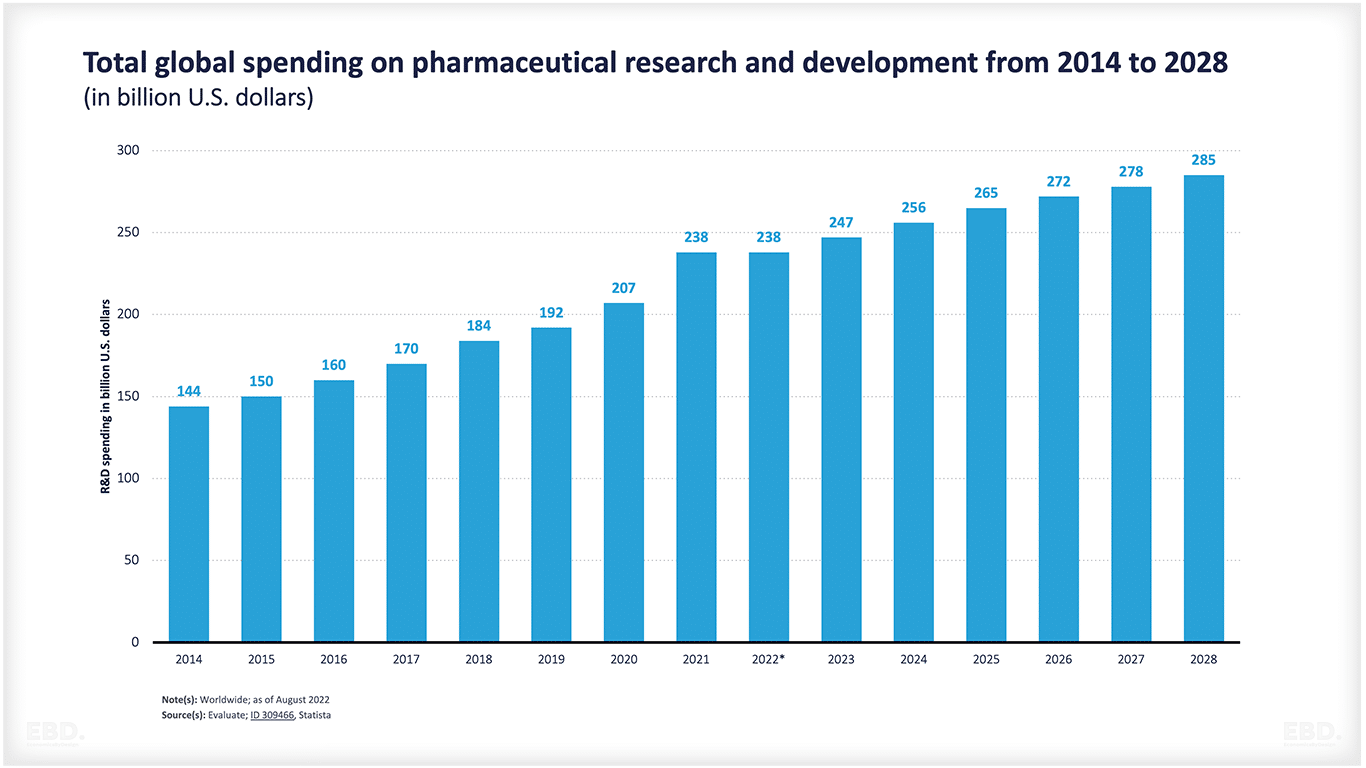
ユネスコ統計研究所に よると、2022年に世界が研究開発に費やした金額は24.7兆ドルに相当します。このうち、医薬品の研究開発に関連する金額は2380億ドルで、2028年には2850億ドルに拡大すると予想されています。
研究開発への資金提供には、民間企業(製薬会社、医療機器メーカー、デジタルヘルス企業など)、助成金や賞の提供を通じた政府、政府が運営する医療サービスプロバイダーでの研究受け入れ、医療研究チャリティーなど多くのステークホルダーが関わっています。
研究開発に投資している世界のトップ製薬会社の例としては、以下のようなものがあります:
世界的に見ても、健康研究のための資金を提供する慈善団体のトップは以下の通りです:
ヘルスリサーチ&ディベロップメントを提供するのは誰か?
健康関連の研究開発のほとんどは、臨床研究者、研究資金提供者から資金提供を受けた臨床医、研究を受け入れる学術医療提供者によって提供されています。
アカデミック・ヘルス・サイエンス・センターは、研究、教育、サービス提供を組み合わせたヘルスケアプロバイダーです。例としては、以下のようなものがあります:
- 米国ジョンズ・ホプキンス (公衆衛生学部、看護学部、医学部)。
- UCLのイングランドでのパートナー
- トルコのNpistanbul Brain Hospital。
- オランダ・ライデン大学医療センター
政府資金による健康研究開発の価値とは?
政府は、慈善事業や商業部門からの投資を刺激し、商業的なインセンティブが比較的乏しい地域で資金へのアクセスを提供するために、医療研究開発に資金を提供しています。
したがって、政府が資金を提供する健康研究開発は、経済成長を刺激し、人口や個人の健康増進を支援することで、価値を高めることができます。
政府による研究開発への資金提供による投資対効果を示す研究はほとんどありませんが、いくつかの研究では、選択したケーススタディについてプラスのリターンを示しています。
- Grant J, Buxton MJ 医学研究資金への経済的リターン BMJ Open 2018;8:e022131. doi: 10.1136/bmjopen-2018-022131 では、健康利益の観点から7%から10%、さらに広い経済効果から15%のリターンを示しました。これは、英国における心血管、がん、筋骨格系の研究への投資に基づいています。
- ヨーク大学のジョイス・クレイグらは、英国におけるバイオメディカル・リサーチ・センターへの資金提供による投資対効果を約29%と試算しています。
- キングスカレッジ・ロンドン、ランド・ヨーロッパ、ブルネル大学のコンソーシアムによる最近の研究では 、約25%の投資対効果が示唆されています(英国での筋骨格系疾患研究に基づく)。
ヘルスケアにおける研究開発の投資価値を考える上で最も重要なのは、それが本質的に不確実であるということです。そこで、医療システムはリスクを取る覚悟を持ち、あるいはリスクを取る覚悟のある企業を支援する必要があるのです。
健康研究開発に関するグローバル・オブザーバトリー
世界の健康研究開発に関する最も優れた情報源のひとつが、世界保健機関(WHO)の「健康研究開発に関するグローバル・オブザーバトリー」です。これは、病気の研究開発に関する世界各地のデータや情報を総合して、情報や分析を提供しています。
何が研究されているのか、どこにギャップがあるのかを知りたい人にとって、実に豊かなリソースとなります。この分野の研究者にとって、ワンストップショップと言えるでしょう。