¿Por qué hay investigación y desarrollo en sanidad?
La investigación y el desarrollo sanitarios son realmente importantes para el sector de la salud. Proporciona a los profesionales clínicos y a los inversores del sistema sanitario innovación y pruebas asociadas para intervenciones de prevención, tratamientos eficaces y vías de atención.
En esta perspectiva económica ofrecemos una visión general de la investigación y el desarrollo sanitarios y de su papel en el sistema sanitario.
¿Qué es la investigación y el desarrollo sanitarios?
La investigación y el desarrollo consisten fundamentalmente en identificar una necesidad o un problema, generar una idea o solución, convertir esa idea en un producto o servicio, probar la eficacia, efectividad y valor del producto o servicio, lanzar el producto o servicio, seguir supervisando, evaluando y mejorando el producto o servicio y, por último, poner fin al producto o servicio cuando se queda obsoleto.
Por lo general, los productos incluyen dispositivos médicos, medicamentos y vacunas, soluciones de terapia génica y herramientas de diagnóstico. También pueden incluir servicios y vías asistenciales como la prevención, el tratamiento y la rehabilitación.
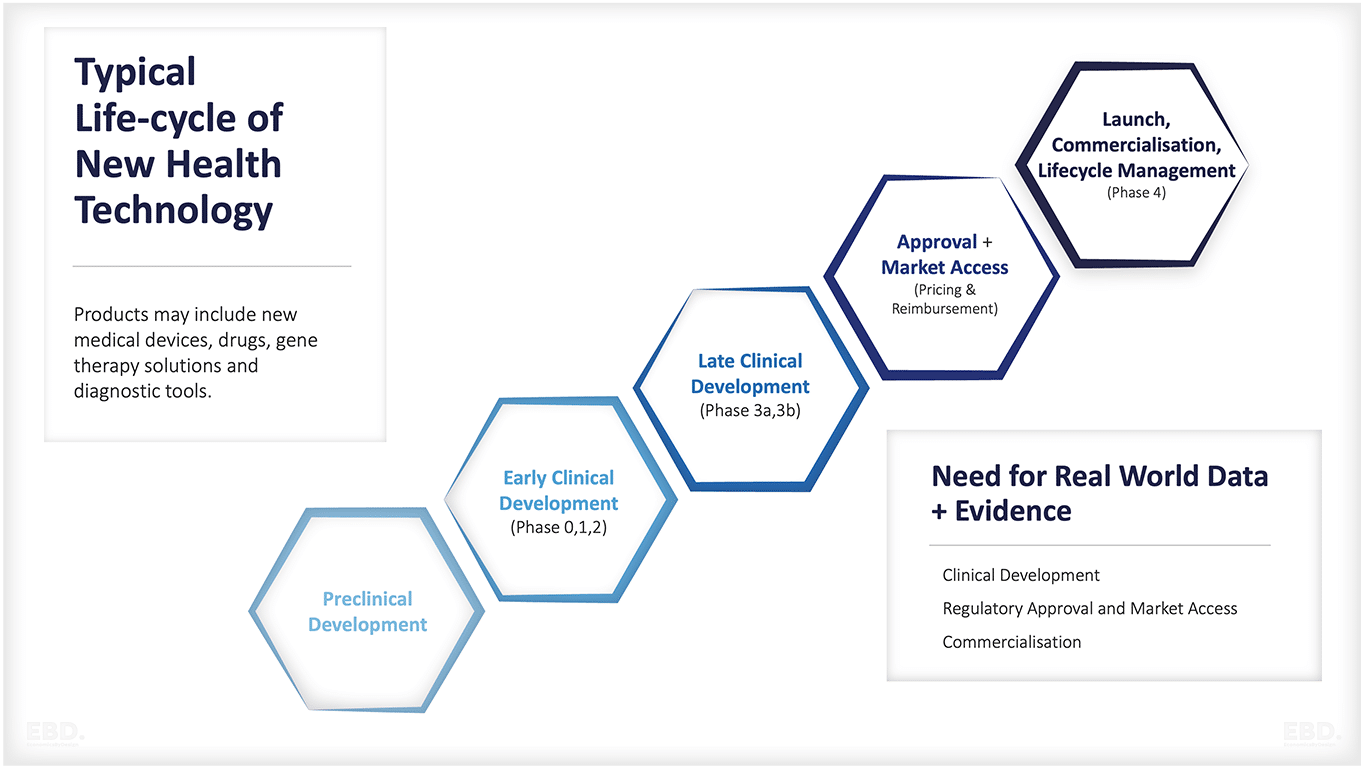
Las etapas clave de la investigación y el desarrollo sanitarios son:
Desarrollo preclínico
Abarca todas las actividades que tienen lugar antes de que un producto o servicio se pruebe en personas. En el caso de intervenciones clínicas como fármacos, dispositivos médicos, terapia génica, herramientas de diagnóstico, etc., se incluyen pruebas de viabilidad, seguridad, etc., a menudo en laboratorios.
Parte del desarrollo preclínico se realiza con animales. Las pruebas in vitro se realizan "fuera del cuerpo" o "fuera del contexto biológico normal", por ejemplo en un tubo de ensayo o una placa de Petri. In vivo es cuando las pruebas se realizan "dentro de la vida" y, en el caso del desarrollo preclínico, se trata de pruebas con animales.
A menudo, el desarrollo preclínico puede incluir lo que se conoce como "estudios observacionales". Se trata de un seguimiento del estado de salud de una población o subgrupo de población para determinar dónde existen problemas y dónde podrían funcionar las intervenciones de prevención y tratamiento.
Desarrollo clínico temprano
Es entonces cuando las pruebas se realizan con personas. Por lo general, en estas primeras fases se comprueba la seguridad o dosificación del fármaco o dispositivo y se observa el impacto de la intervención clínica en los seres humanos. Esta etapa suele incluir ensayos clínicos de "fases 0, 1 y 2", que son estudios de investigación que prueban el impacto de un producto o servicio en las personas. La fase del ensayo suele reflejar el número de participantes, que aumenta a medida que se aprende más sobre la dosificación, la seguridad y los efectos secundarios.
Desarrollo clínico tardío
Esta es la fase en la que el producto o servicio se prueba a escala en una población. Estos ensayos de la fase 3 son complejos, requieren mucho tiempo y suelen ser caros. El objetivo del ensayo es comprobar el impacto del producto o servicio en los resultados sanitarios.
Es importante aislar el impacto del producto o servicio de otros factores que explican de forma independiente los cambios en los resultados sanitarios. Por estas razones, los ensayos clínicos de fase 3 suelen diseñarse como ensayos controlados aleatorizados (ECA).
Un ECA implica asignar aleatoriamente a los participantes en el ensayo a diferentes grupos: los que reciben la intervención (el grupo de tratamiento) y los que no (el grupo de control). A menudo esto se hace "a ciegas", de modo que el participante no sabe realmente si está recibiendo la intervención o no. En el caso de un fármaco, pueden, por ejemplo, recibir un "placebo" (un tratamiento sin valor terapéutico).
A veces, el ensayo de fase 3 puede ser "doble ciego", en el que el profesional sanitario que administra la intervención no sabe qué participante recibe el tratamiento o el placebo.
Si la población del ensayo es representativa de la población general o de la población diana del tratamiento, el proceso del ECA puede garantizar que todos los factores que podrían influir en el resultado sanitario (como la edad, otras condiciones de salud, la forma física, etc.) tienen la misma probabilidad de interferir en el grupo de tratamiento y en el grupo de control y, por tanto, pueden ignorarse. La única razón para un resultado sanitario diferente entre el grupo de tratamiento y el grupo de control es el valor terapéutico del producto o servicio.
En la práctica, es muy difícil y/o caro diseñar ECA, por lo que a menudo los ensayos de fase 3 utilizan otras técnicas para minimizar el riesgo de lo que se conoce como "sesgo de atribución", es decir, que las diferencias observadas en los resultados del grupo de tratamiento se atribuyan erróneamente al producto o servicio.
Es importante destacar que, si el producto o servicio requiere aprobación reglamentaria, los ensayos clínicos de la fase 3 suelen realizarse después de presentar una solicitud de aprobación reglamentaria, pero antes de que se conceda.
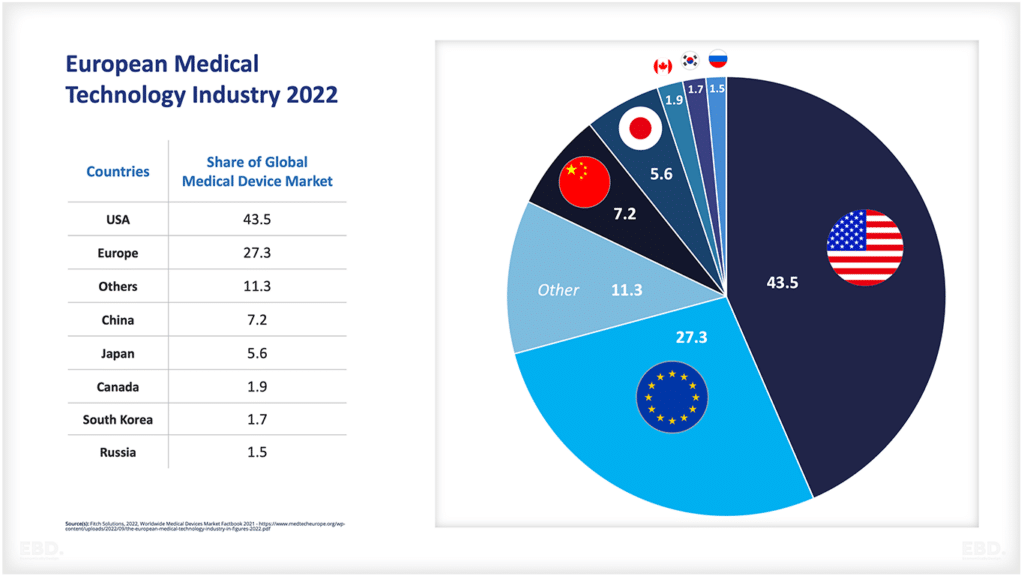
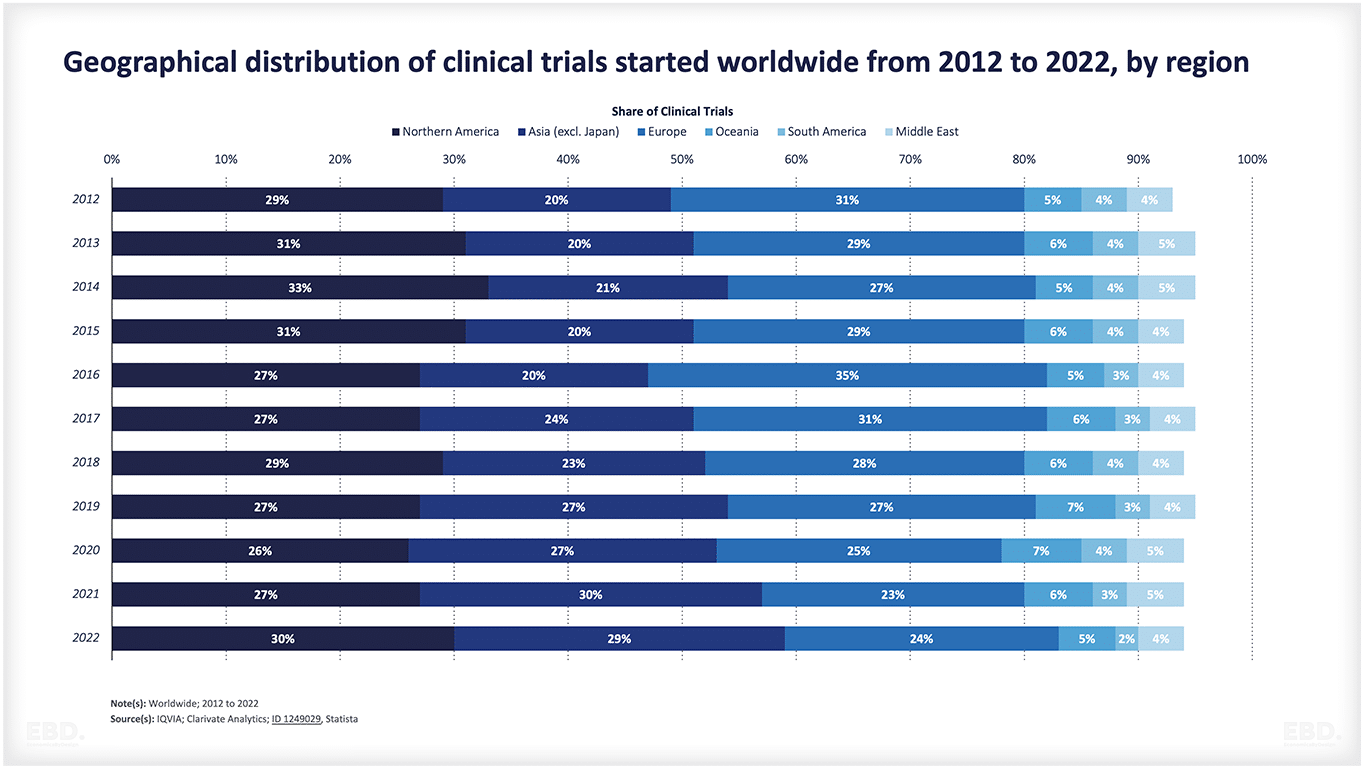
El siguiente gráfico muestra que, en la actualidad, la gran mayoría de los ensayos clínicos se realizan en Norteamérica, Asia y Europa.
Autorización de comercialización, fijación de precios y reembolso
En esta fase, el producto o servicio es aprobado por el organismo regulador pertinente (si es necesario) y es cuando se toman las decisiones de fijación de precios y reembolso con los responsables de pagar o encargar la asistencia sanitaria en nombre de una población.
Esta fase suele requerir la recopilación de información adicional y, en particular, de datos económicos que demuestren el valor del producto o servicio. Es lo que se conoce como Evaluación de Tecnologías Sanitarias (ETS). Se pedirá a la organización que ha desarrollado el producto o servicio que presente datos para apoyar este proceso y el pagador encargará a expertos independientes que lleven a cabo la HTA.
Para algunos pagadores, existen puntos de referencia o directrices claras en relación con la eficacia y el valor que deben alcanzarse para que el producto o servicio se incluya en el paquete de prestaciones sanitarias. Para otros, las decisiones se toman caso por caso. A menudo, las decisiones de incluir productos o servicios como parte de las prestaciones sanitarias esenciales se toman con el asesoramiento de un comité de especialistas formado por expertos en la materia y representantes de los pacientes.
Cada vez más, las entidades pagadoras y reguladoras vinculan la aprobación, la fijación de precios y el reembolso a la exigencia de que el producto o servicio se someta a algunos requisitos adicionales de recopilación de datos y vigilancia para garantizar su eficacia y valor.
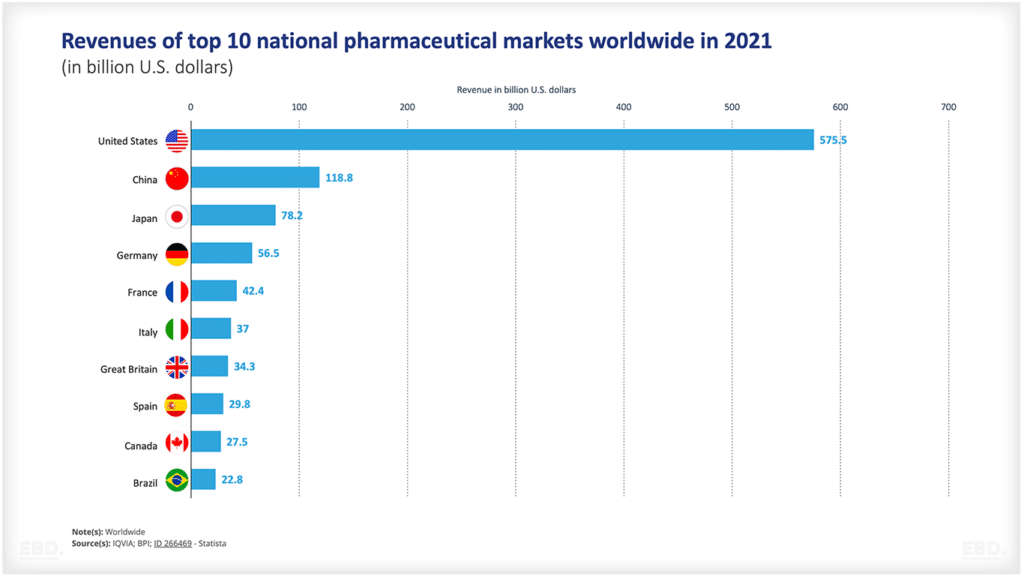
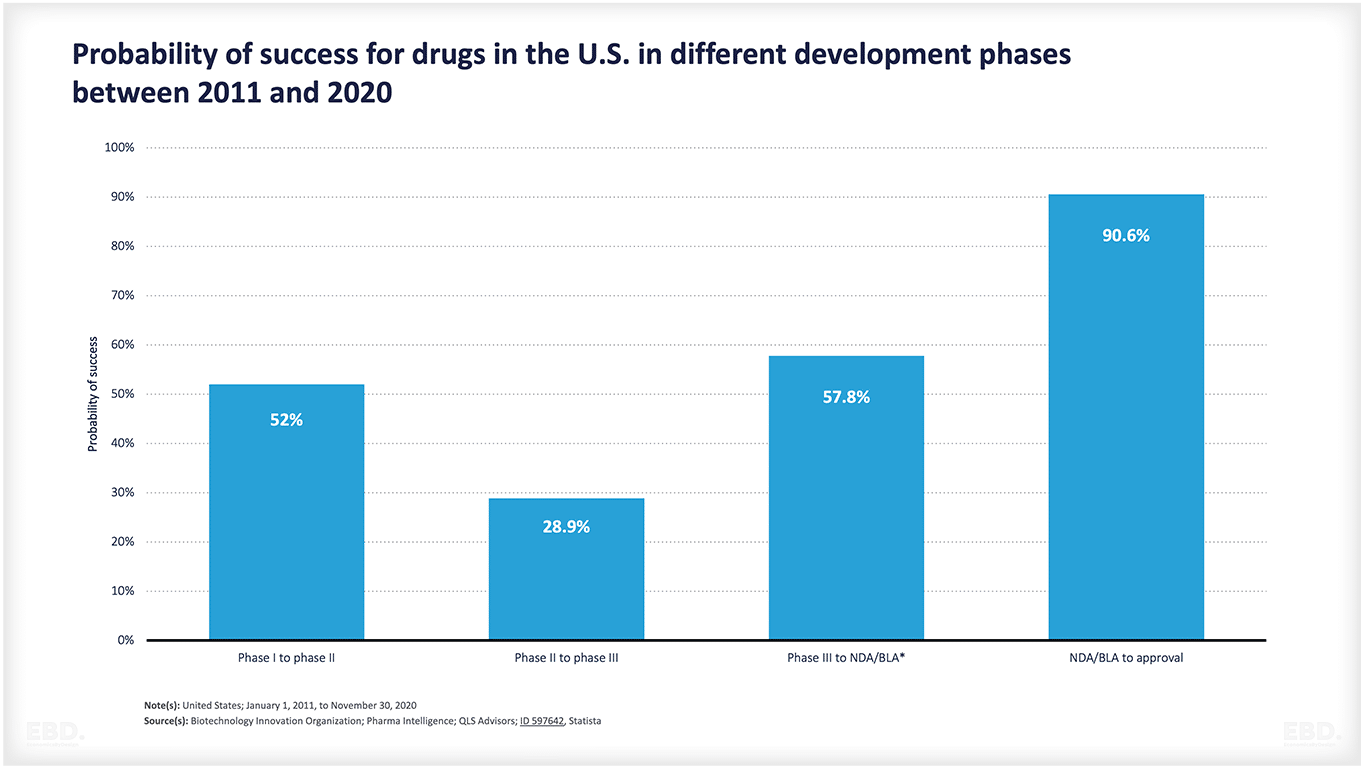
Como indica el gráfico siguiente, muchos productos no pasan de la fase de concepción a la de aprobación. Hay mucha incertidumbre científica o tecnológica. Este gráfico muestra que, en el caso de los medicamentos en EE.UU., alrededor de la mitad pasan de la fase 1 a la 2 y alrededor del 29% de ellos de la 2 a la 3. Más de la mitad pasan a la fase de acceso al mercado y, si lo consiguen, más del 90% son aprobados. Más de la mitad pasan a la fase de acceso al mercado y, si lo consiguen, más del 90% obtienen la aprobación. Sin embargo, en conjunto, sólo el 7,8% de los medicamentos pasan de la fase preclínica a la de aprobación. Esto supone una enorme cantidad de recursos dedicados a productos que no llegan a lanzarse al mercado.
Lanzamiento, comercialización, gestión del ciclo de vida
Esta fase abarca todas las actividades de investigación y desarrollo relacionadas con un producto o servicio sanitario una vez que se ha adoptado para su implantación entre la población. Las actividades incluyen el control de la seguridad y los efectos secundarios, el seguimiento del impacto y la recopilación de datos reales que sirvan de base para decidir si el producto puede ampliar su cobertura o los tipos de enfermedades que puede tratar.
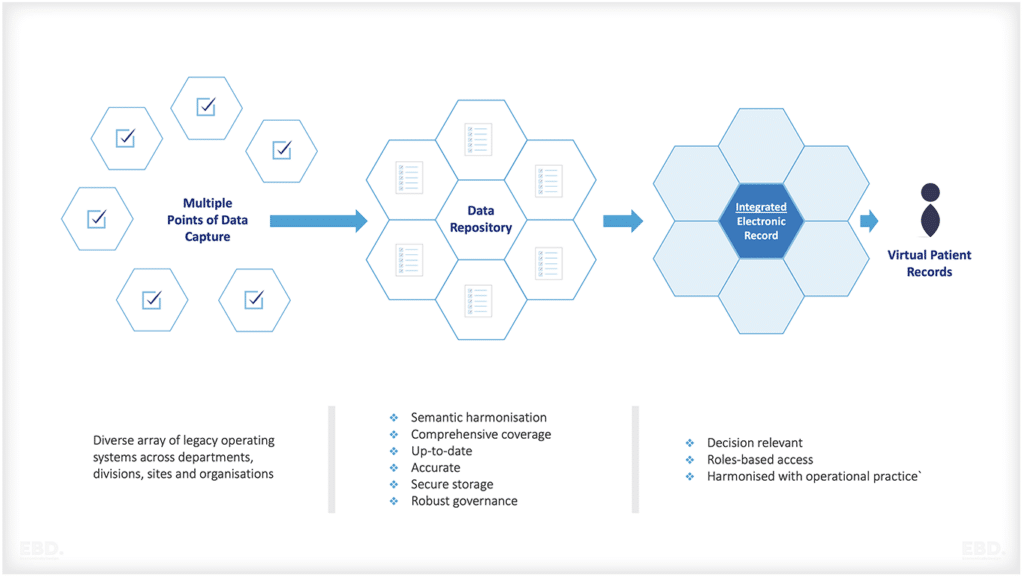
¿Qué son los datos y pruebas del mundo real?
Las partes interesadas en la investigación y el desarrollo de los sistemas sanitarios recurren cada vez más al uso de datos y pruebas del mundo real para fundamentar sus decisiones. Los datos del mundo real son datos recopilados de forma rutinaria dentro y fuera del sistema sanitario. Las pruebas del mundo real se basan en el análisis de datos del mundo real.
Entre los posibles usos de los datos y pruebas del mundo real se incluyen:
Desarrollo clínico
- Priorizar el desarrollo clínico temprano
- Estudiar la enfermedad y su carga
- Estudiar la gestión de la enfermedad
- Diseño de ensayos clínicos
- Ejecución de ensayos Aumentar la eficacia de la captación de pacientes
Autorización reglamentaria + acceso al mercado
- Facilitar el proceso normativo
- Facilitar la fijación de precios, el reembolso y el acceso al mercado
Comercialización
- Aportar nuevos conocimientos científicos y clínicos
- Proporcionar información comercial y de negocio
- Apoyar los programas comerciales
- Facilitar la farmacovigilancia y la vigilancia posteriores a la comercialización
- Optimización de la gestión de pacientes
- Ampliación de la indicación
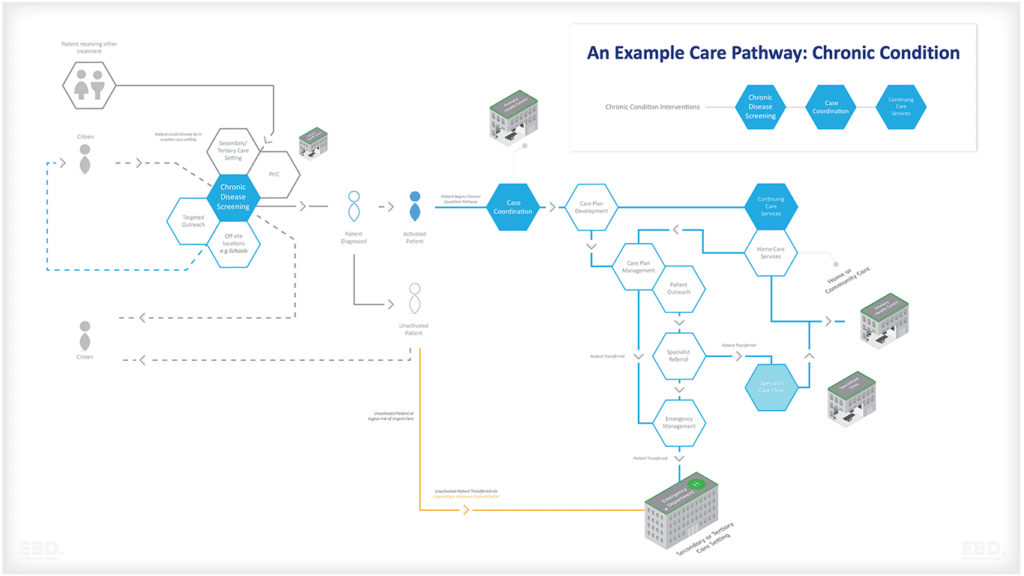
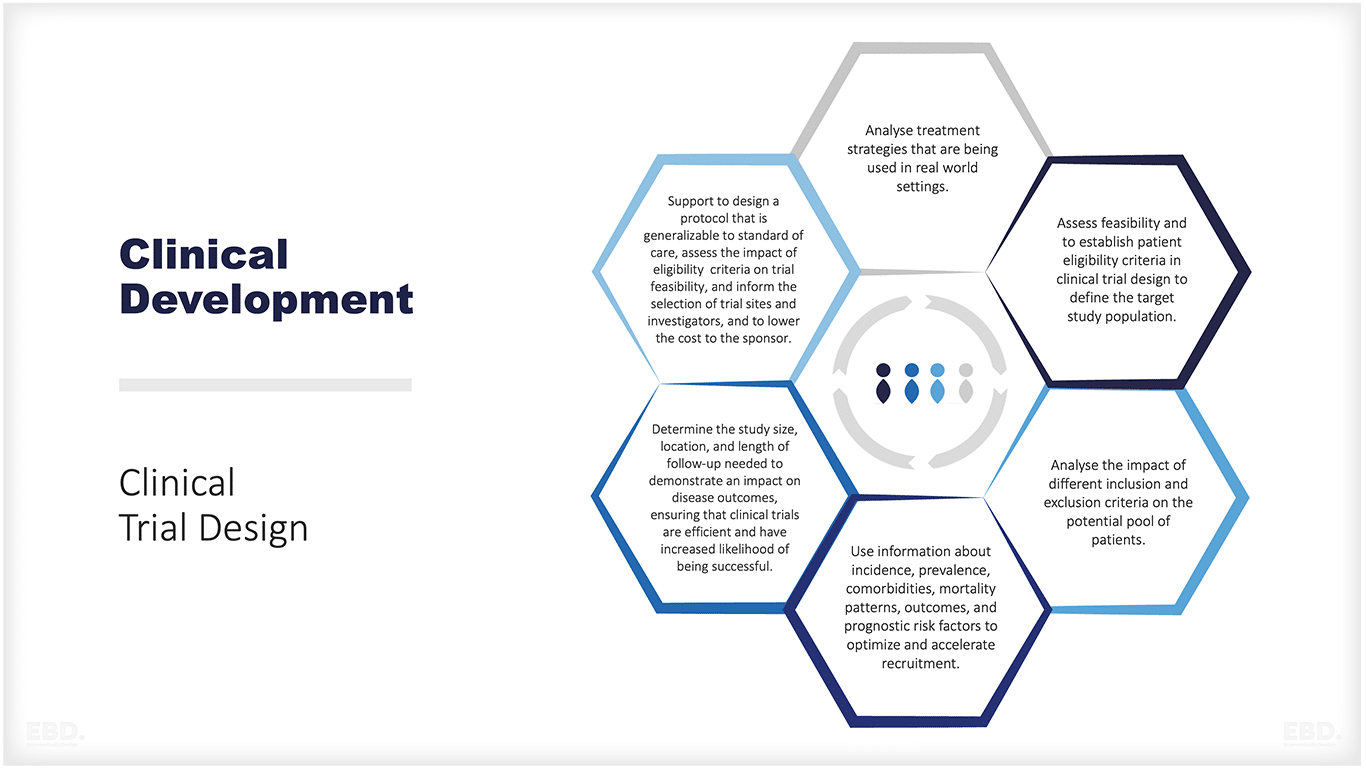
La figura siguiente ofrece un resumen de los tipos de cuestiones en las que los datos del mundo real pueden apoyar el diseño y la realización de un ensayo clínico eficaz.
Características de una fuente de datos ideal para generar pruebas del mundo real
- Población de pacientes representativa de los que padecen la enfermedad subyacente (por ejemplo, demografía, comorbilidades clínicas).
- Planificación prospectiva
- Actualización continua con recursos mínimos
- Seguimiento longitudinal
- Datos clínicos completos: introducidos por el médico, comunicados por el paciente y generados por el paciente
- Medidas de control de calidad
- Integración en los sistemas de datos existentes
Los datos del mundo real plantean problemas. Estos datos pueden ser de calidad variable en términos de precisión, también pueden tener una cobertura parcial. Los datos del mundo real no son necesariamente regulares u oportunos, y pueden no proporcionar información exhaustiva en todas las áreas de interés. Sin embargo, a medida que maduran las capacidades digitales de los sistemas sanitarios, estas cuestiones se están convirtiendo en un obstáculo cada vez menor para el uso de datos del mundo real por parte de la comunidad de investigación y desarrollo.
¿Qué es la gobernanza de la investigación?
La investigación y el desarrollo en el ámbito sanitario plantean muchas cuestiones éticas. Se pide a los participantes en la investigación que sean bancos de pruebas humanos para nuevos productos y servicios que pueden no funcionar o, peor aún, ser perjudiciales. A menudo se les pide que participen porque ya padecen una afección o enfermedad. También se les pide que faciliten datos e información muy personales a un equipo de investigación.
La gobernanza de la investigación se define como los reglamentos, reglas, principios y normas que garantizan y aseguran una investigación de alta calidad. Una gobernanza de la investigación bien diseñada debe ofrecer garantías a todas las partes interesadas de que la investigación se lleva a cabo de acuerdo con las normas de calidad exigidas, tiene un propósito y un valor, y que se cumplen las normas de participación, protección de los participantes e investigadores y puesta en común de la información.
La gobernanza de la investigación abarca todas las investigaciones relacionadas con la salud en las que intervienen personas, sus tejidos o sus datos.
Las disposiciones para la gobernanza de la investigación varían en todo el mundo. En algunos países, existen disposiciones estrictas y se requiere la aprobación de toda investigación en la que participen personas, sus tejidos o sus datos. La aprobación ética estará condicionada a la calidad del protocolo de investigación y a la existencia de acuerdos de consentimiento para los participantes.
En algunos países, estos acuerdos aún no se han establecido. Cuando la investigación se lleva a cabo en países donde no existe una gobernanza de la investigación y/o donde no se ha concedido la aprobación ética, puede resultar difícil para los investigadores ver su investigación publicada en revistas revisadas por pares.
Algunos ejemplos útiles de acuerdos y organizaciones de gobernanza de la investigación son:
- El Reglamento Europeo de Ensayos Clín icos, que regula los ensayos clínicos en toda la Comisión Europea.
- La Autoridad de Investigación Sanitaria del NHS ofrece un marco político para las buenas prácticas en la gestión y realización de investigaciones sanitarias y de asistencia social en el Reino Unido.
- El sitio web ClinRegs del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAD) de EE.UU. ofrece información específica sobre la normativa de investigación clínica en determinados países de todo el mundo.
¿Cuánto se invierte en investigación y desarrollo sanitarios?
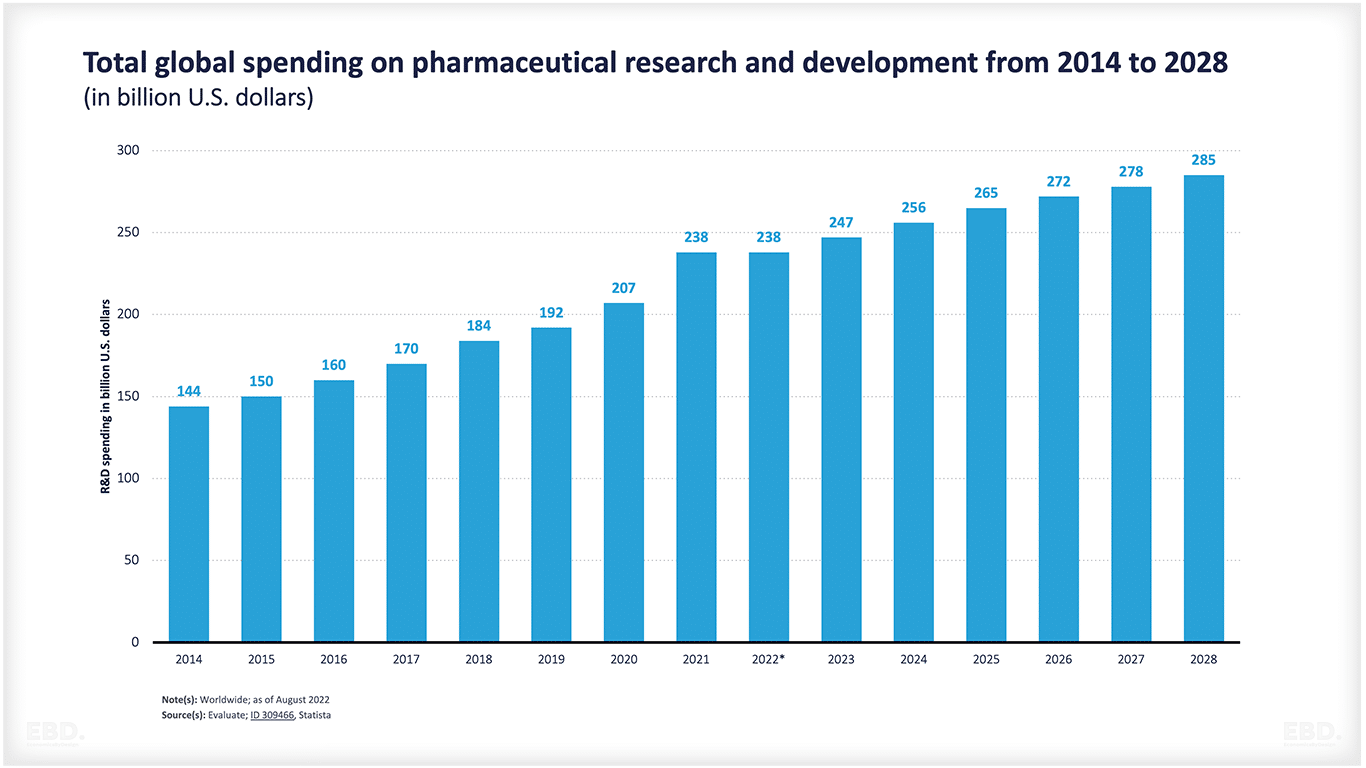
Según el Instituto de Estadística de la UNESCO , el mundo gastó el equivalente a 2.470 millones de dólares en investigación y desarrollo en 2022. De ellos, 238.000 millones corresponden a investigación y desarrollo farmacéutico, y se espera que esta cifra aumente hasta 285.000 millones en 2028.
Hay muchas partes interesadas en la financiación de la investigación y el desarrollo, incluidas empresas privadas (por ejemplo, farmacéuticas, de dispositivos médicos o de salud digital), el gobierno a través de la concesión de subvenciones y premios, y mediante la acogida de la investigación en los proveedores de servicios de salud gestionados por el gobierno, y las organizaciones benéficas de investigación médica.
Algunas de las principales empresas farmacéuticas mundiales que invierten en investigación y desarrollo son:
Entre los principales financiadores filantrópicos de la investigación sanitaria mundial figuran:
- Wellcome Trust
- Instituto Médico Howard Hughes
- Fundación Bill y Melinda Gates
- Instituto Pasteur
- Fundación Oswaldo Cruz
- Fundación Rockefeller
¿Quién se encarga de la investigación y el desarrollo sanitarios?
La mayor parte de la investigación y el desarrollo sanitarios corre a cargo de académicos clínicos, médicos financiados por entidades de financiación de la investigación y proveedores de atención sanitaria académica que acogen la investigación.
Los Centros Académicos de Ciencias de la Salud son proveedores de asistencia sanitaria que combinan investigación, educación y prestación de servicios. Algunos ejemplos son:
- Johns Hopkins (Escuela de Salud Pública, Escuela de Enfermería, Escuela de Medicina) en EE.UU.
- Socios de la UCL enInglaterra
- Npistanbul Brain Hospitalen Turquía
- Centro Médico de la Universidad de Leiden (Países Bajos)
¿Cuál es el valor de la investigación y el desarrollo sanitarios financiados por el gobierno?
Los gobiernos financian la investigación y el desarrollo sanitarios para estimular la inversión de los sectores filantrópico y comercial, y para facilitar el acceso a fondos en áreas donde los incentivos comerciales son relativamente escasos.
Por tanto, la investigación y el desarrollo sanitarios financiados por los gobiernos pueden aportar un valor añadido, tanto estimulando el crecimiento económico como apoyando la mejora de la salud de la población y los individuos.
Se dispone de muy pocos estudios que demuestren la rentabilidad de la inversión en investigación y desarrollo financiada por los Gobiernos, pero algunos de ellos han arrojado resultados positivos en casos concretos.
- Grant J, Buxton MJ Los retornos económicos de la financiación de la investigación médica BMJ Open 2018;8:e022131. doi: 10.1136/bmjopen-2018-022131 mostraron retornos de entre el 7% y el 10% en términos de ganancia de salud, y un 15% adicional del impacto económico más amplio. Esto se basó en la inversión en investigación cardiovascular, oncológica y musculoesquelética en el Reino Unido.
- Joyce Craig y sus colegas de la Universidad de York calcularon que el rendimiento de la inversión derivada de la financiación de los Centros de Investigación Biomédica en el Reino Unido rondaba el 29%.
- Un estudio reciente de un consorcio formado por el Kings College de Londres, RAND Europe y la Universidad de Brunel sugiere un rendimiento de la inversión de alrededor del 25% (basado en la investigación de enfermedades musculoesqueléticas en el Reino Unido).
El factor más importante que hay que tener en cuenta al analizar el valor de inversión de la investigación y el desarrollo en el sector sanitario es que es inherentemente incierto. Por ello, los sistemas sanitarios deben estar dispuestos a asumir riesgos y/o apoyar a las empresas que están dispuestas a asumirlos.
Observatorio Mundial de I+D en Salud
Una de las mejores fuentes de información sobre investigación y desarrollo sanitarios a escala mundial es el Observatorio Mundial de I+D en Salud de la Organización Mundial de la Salud. Ofrece información y análisis basados en una síntesis de datos e información de todo el mundo sobre investigación y desarrollo de enfermedades.
Es un recurso realmente rico para cualquiera que desee saber qué se está investigando y dónde hay lagunas. Es una ventanilla única para los investigadores en este campo.