医薬品は、病気をコントロールし治療するための薬や薬剤を提供するために開発された化学物質です。医薬品の使用に関する記録は約3万年前にさかのぼりますが、薬学ははるかに新しい現象です。現代の医薬品産業の発展は、19世紀初頭に始まった比較的新しいものです。
製薬会社は製品を説明する際に複雑な用語を使用しますが、ここでは一般的な用語を紹介します。
治療クラス
治療クラスとは、類似の病状や病気の治療に使用される医薬品のグループである。治療クラスは、1つの薬剤を含む場合もあり、その場合は単体の医薬品とみなされます。また、複数の薬剤を含む場合もあり、これは配合剤と呼ばれます。一般的に処方される治療薬クラスには、抗高血圧薬、抗うつ薬、鎮痛薬などがあります。
新薬
新薬とは、これまで承認されてきた医薬品とは異なる、新しい革新的な医薬品と定義されることが多い。しかし、この用語は、これまで満たされていなかった公衆衛生上のニーズを持つ患者さんが利用できる医薬品を指す場合にも使用されます。最近の例では、神経発達障害であるレット症候群の治療薬としてデイビュがFDAに 承認されたことが挙げられます。
医薬品特許
特許は、新しい医薬品の発明者を法的に保護するものです。特許権者は、特許が出願された日から20年間、発明品を製造、使用、販売する独占的権利を有します。特許が切れた後は、他のメーカーがその医薬品のジェネリックバージョンを製造することができます。20年という期間は、研究開発費を回収し、利益を還元するのに十分な期間と考えられている。
実際には、製品の使用が承認されるまでに長い時間がかかるため、企業は発売後、より限られた期間だけ保護を受けることができます。特許は国際的なものではないので、技術的には製品を販売する国で申請する必要がある。世界貿易機関(WTO)が管理する知的財産権の貿易関連の側面(TRIPS)の一部として、特許の調和が図られています。
ジェネリック医薬品
ジェネリック医薬品とは、先発医薬品と同じになるように作られた医薬品のことです。ジェネリック医薬品は通常、先発医薬品と同等品よりもはるかに安く、一般的には風味、色、形などが異なるだけです。
ジェネリック医薬品は、既存の先発品の特許が切れた後に開発されることがあります。しかし、特許が発達していない国や特許が認められていない国では、国内でのジェネリック医薬品の製造を認めているところもあります。ジェネリック医薬品の一般的な例として、パラセタモールが挙げられますが、これはパナドールなどのブランド品としてより高い価格で販売されています。
生物学的製剤
生物学的製剤は、生物学的製剤とも呼ばれ、生物またはその構成要素の助けを借りて生産される医療上重要な物質です。生物学的製剤は、関節リウマチ、乾癬、クローン病、多発性硬化症などの慢性疾患の治療に有効であることから、ますます人気が高まっています。生物学的製剤の例としては、がんの患者さんにはベバシズマブ(アバスチン)、関節炎の患者さんにはアダリムマブ(ヒュミラ)などが挙げられます。
バイオシミラー
生物学的製剤は複雑であるため、ジェネリック医薬品は常に可能というわけではありません。そのため、基準生物学的製剤と治療効果が類似しているバイオシミラーの開発が試みられています。バイオシミラーには、組成、分子構造、不純物などの点で小さな違いがあるため、類似しているだけで、同一ではない可能性があります。しかし、このようなわずかな違いは臨床的に意味のあるものではありません。
オーファンドラッグ(希少疾病用医薬品
希少医薬品とは、希少な病気や症状の治療に用いられる医薬品で、一般的に他の医薬品と比較して販売量が非常に少ないものを指します。これらの医薬品は開発コストが高く、一般的に製薬会社にとって投資対効果の高いものではありません。しかし、多くの国では、企業がオーファンドラッグを開発する際に与えられる市場独占権や税控除などのインセンティブがあります。
オーファンドラッグの例としては、多発性硬化症治療薬、嚢胞性線維症治療薬Kalydeco(ivacaftor)、Algluceraseがあります:肝臓、脾臓、肺、骨髄の組織に痛みと損傷を与えるゴーシェ病の治療薬。
処方箋医薬品
処方薬とは、医師による処方箋がなければ入手できない医薬品のことです。通常、処方箋がなければ合法的に入手できない薬物の例としては、ペニシリンなどの抗生物質、オキシコンチンなどのオピオイド、バリウムなどのベンゾジアゼピンなどがあります。
処方箋の要件は、通常、誤用や乱用の可能性があり、医薬品が医療資格者によって安全かつ効果的に使用されることを保証する必要がある場合に設けられる。また、患者さんの薬代を賄うための補助金がある場合にも、処方箋が必要となります。
オーバー・ザ・カウンター(OTC)
市販薬、または非処方薬は、医師の処方箋を必要とせず、お店で購入することができる医薬品です。これらの薬は一般的に、一般の人が使っても安全だと考えられており、通常、痛み、咳、風邪などの一般的な病気を治療します。市販薬の例としては、痛みに効くイブプロフェン、アレルギーに効くロラタジン、咳に効くグアイフェネシンが挙げられます。
効能・効果
医薬品は通常、「適応症」と呼ばれる特定の病状に対して使用することが承認されています。一部の医薬品は、複数の適応症に使用することができます。例えば、腫瘍(がん)治療薬は、多くの場合、複数の適応症で承認されています。医薬品が「適応外」で処方されることもあります。つまり、承認された適応症以外の症状の治療に使用されるのです。通常、このようなことは、患者さんにとって代替治療がなく、それが何らかの治療的価値があると考えられる場合にのみ起こります。
ワクチン
ワクチンは、生物学的製剤の一種で、通常、特定の病気の原因となる生物を弱めたり殺したりしたものから作られます。ワクチンは、個人の免疫システムを活性化させ、将来同じウイルスに感染したときに撃退できるようにするためのものです。通常、注射で投与されますが、経口投与や鼻腔スプレーで投与されることもあります。ワクチン開発の成功例としては、麻疹・おたふく・風疹ワクチン(MMR)、B型肝炎ワクチンなどがあります。
COVID-19のパンデミックは、安全で効果的なCOVID-19ワクチンの開発を早急に進めるために、世界的に大規模な科学的努力が行われました。世界保健機関(WHO)は、人口の少なくとも70%がワクチン接種を受けるよう各国に呼びかけました。ワクチンの開発は、前臨床試験と臨床試験を並行して行い、通常は連続して行われるところを、時間をかけて行うことで迅速化されたのです。欧州医薬品庁(European Medicines Agency)のウェブサイトには、開発期間を短縮した方法についての概要が掲載されており、大変参考になります。
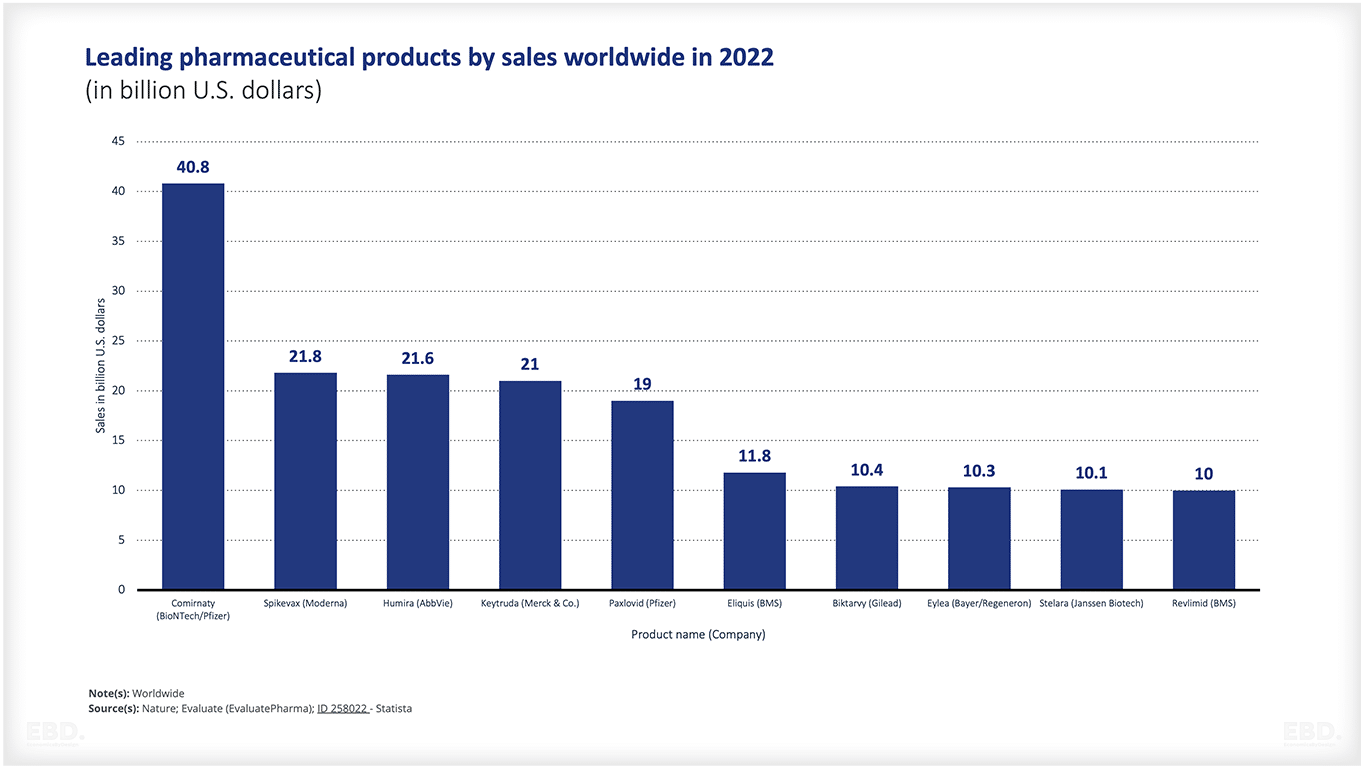
世界の医薬品トップ10
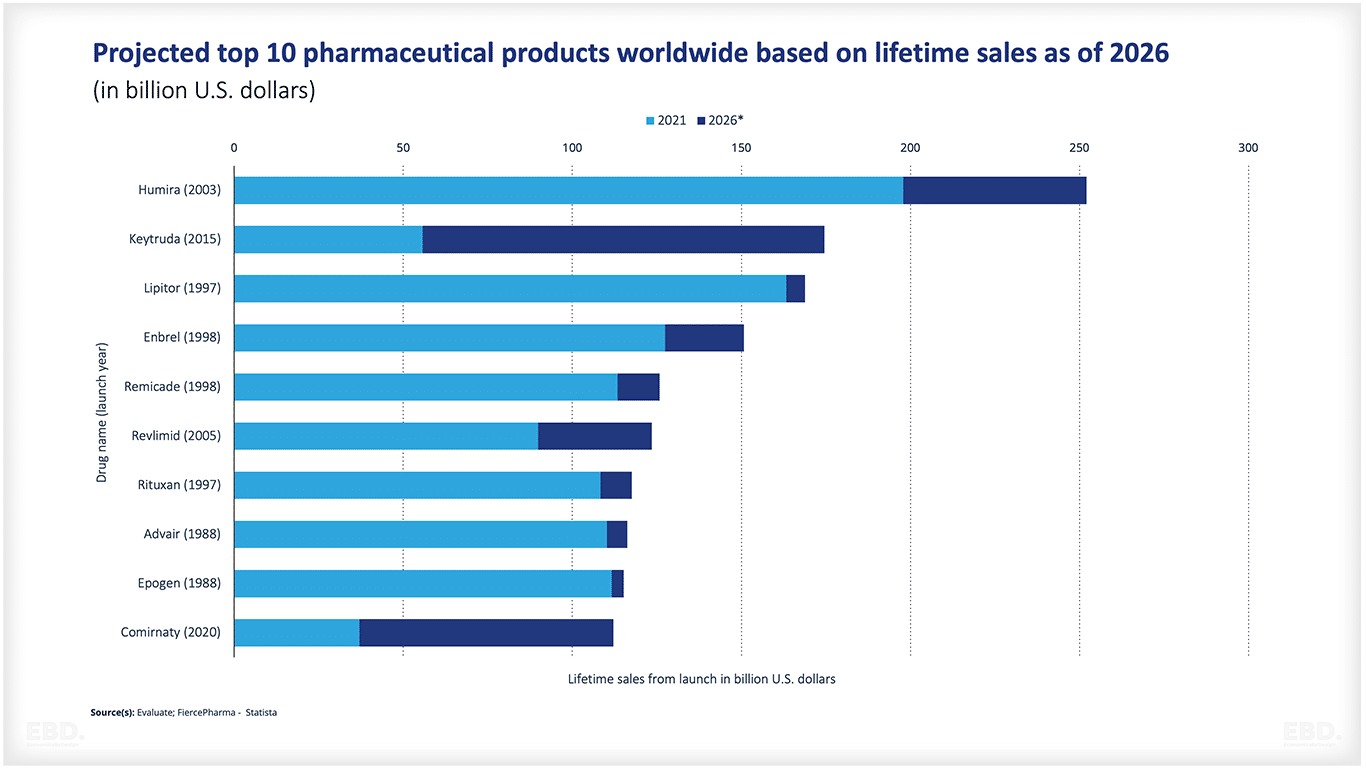
下図は、生涯売上高に基づく医薬品上位10品目の予測です。ご覧のように、Comirnaty(2020年)がすでにリストに含まれています。Comirnatyは、BioNTech Pfizerのワクチンの名前で、Covid-19の予防と影響を緩和するために設計された、最近開発・承認されたワクチンの1つです。
製薬業界の規模は?
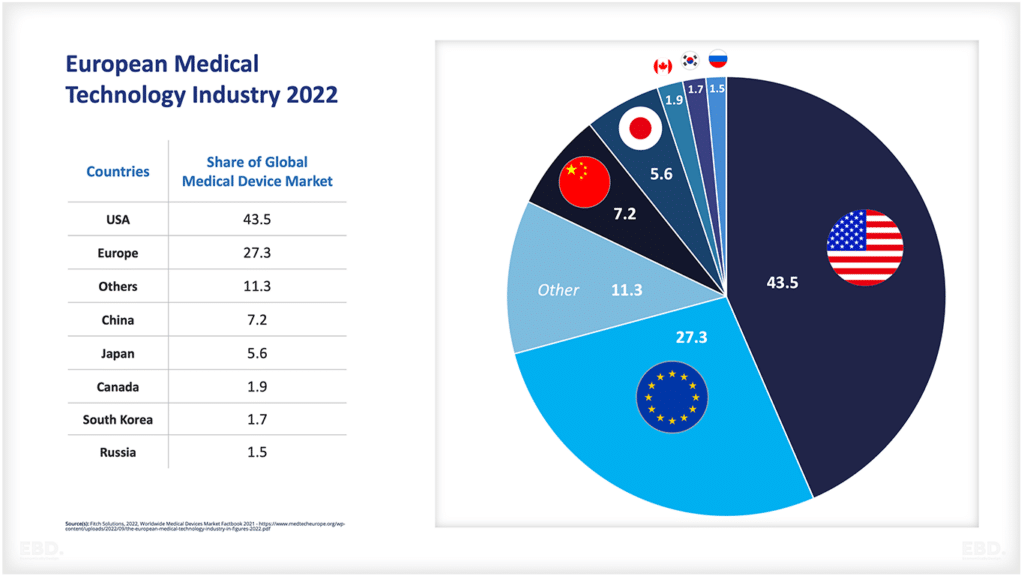
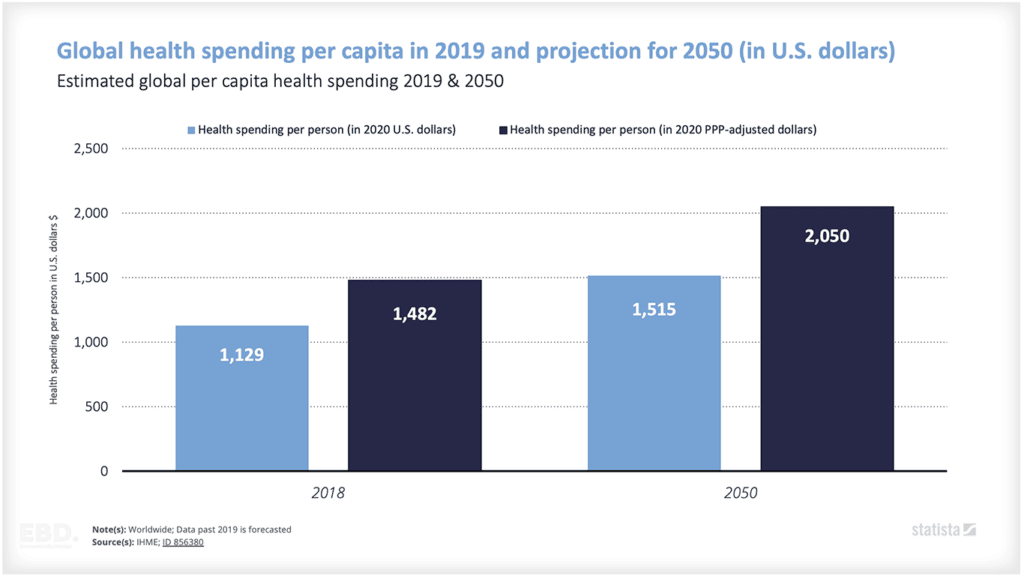
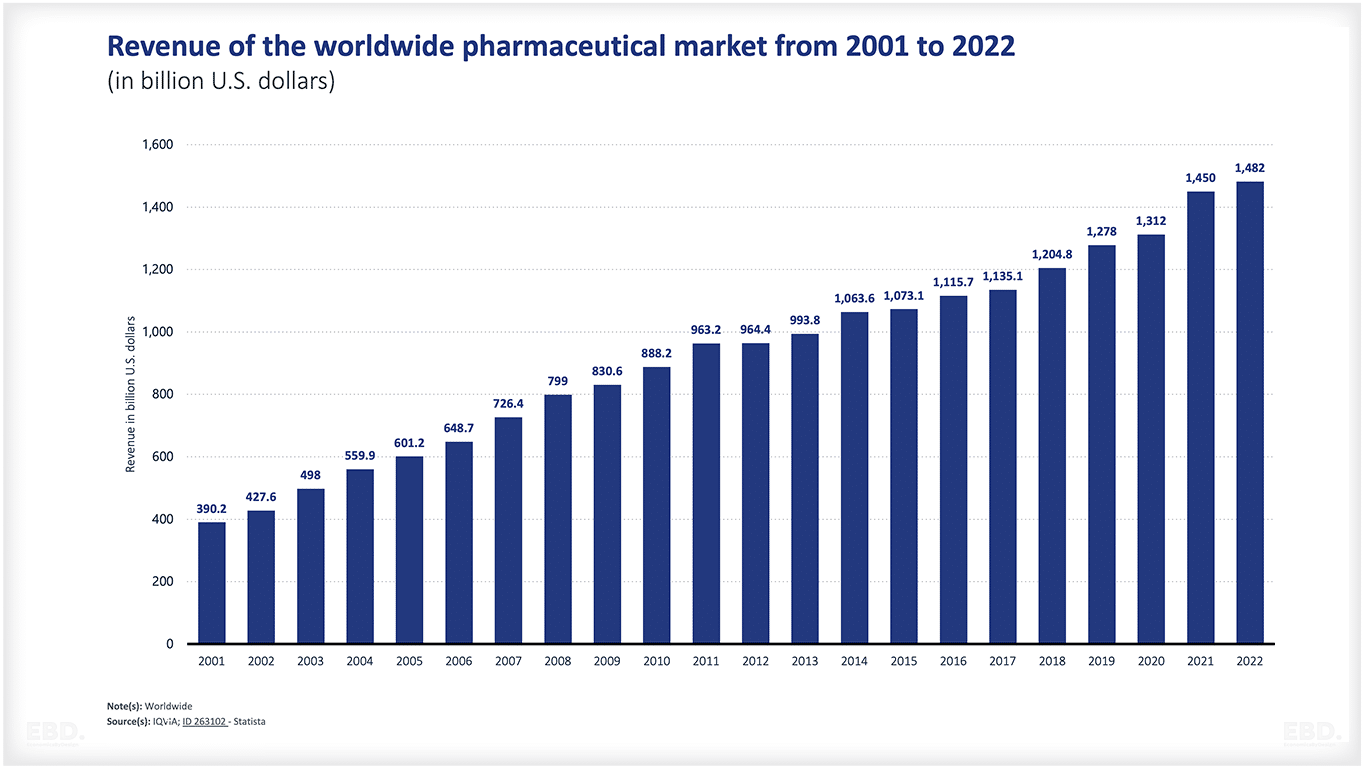
前述のとおり、世界の医薬品市場の売上高は、2022年には1兆4,820億米ドルに達すると推定されています。米国が圧倒的に大きく、次点の中国の4倍以上の市場規模となっています。
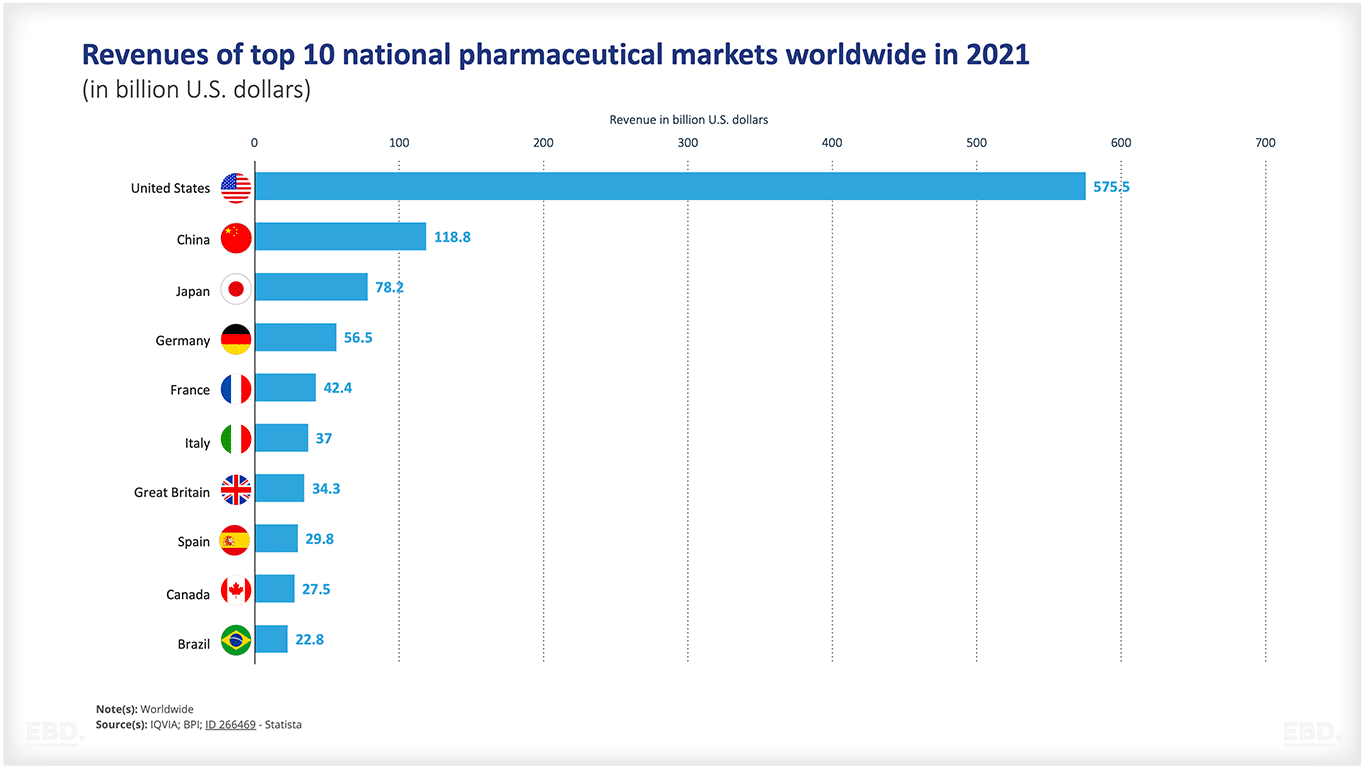
|
ユーエスエー |
575.5 |
|
中国 |
118.8 |
|
日本 |
78.2 |
|
ドイツ |
56.5 |
|
フランス |
42.4 |
|
イタリア |
37 |
|
グレートブリテン |
34.3 |
|
スペイン |
29.8 |
|
カナダ |
27.5 |
|
ブラジル |
22.8 |
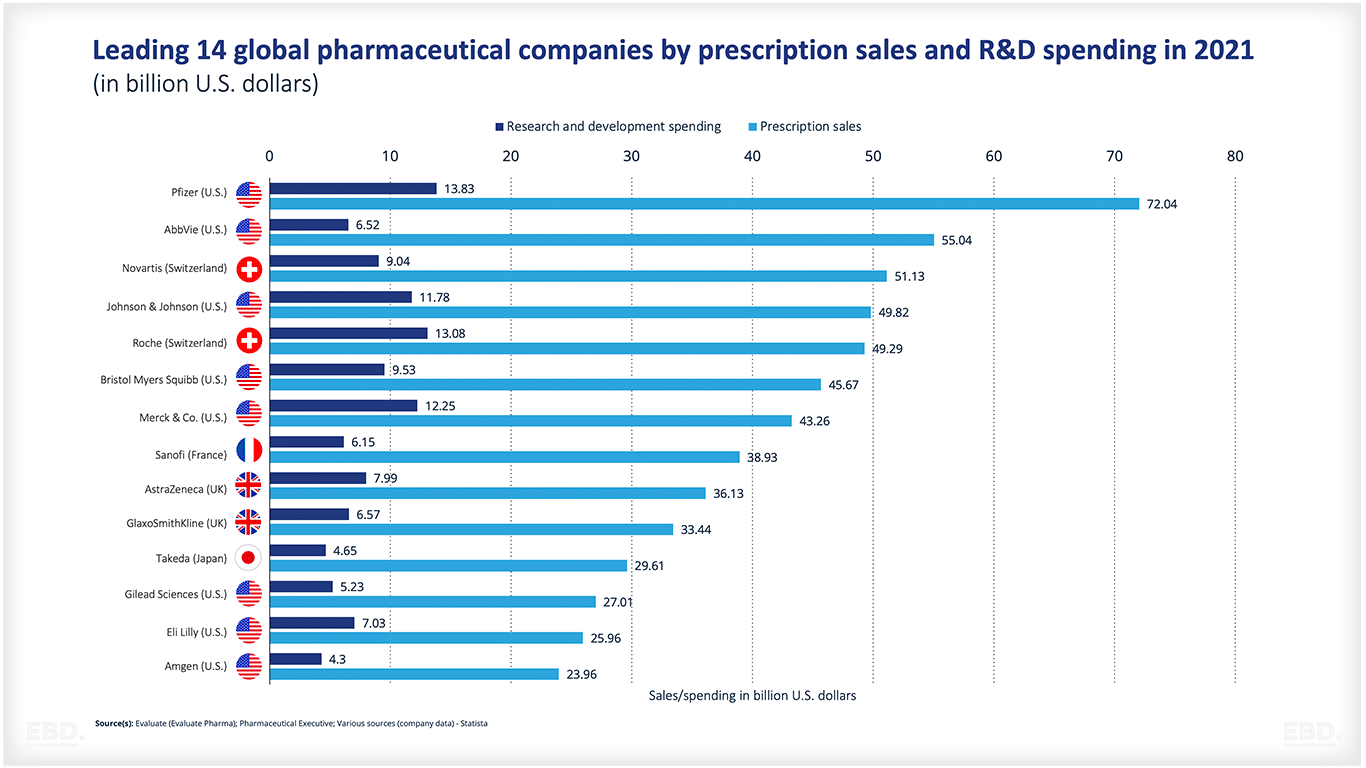
主な製薬会社はどこですか?
世界的な大手製薬会社の例としては、以下のようなものがあります:
これらの企業の中には、特定の治療クラスに特化した企業もあります。例えば、ノボノルディスクは糖尿病に特化しています。また、J&Jやファイザーのように、幅広いポートフォリオを持つ企業もあります。
研究・開発
すべての製薬会社は、処方箋の売上高に比して研究開発に多額の投資を行っています。ユネスコ統計研究所 によると、2022年に世界が費やした研究開発費は24.7兆ドルに相当します。このうち、医薬品の研究開発費は2380億ドルで、2028年には2850億ドルに増加すると予想されています。研究開発に関する詳しい情報は、こちらをご覧ください。
医薬品の価格は何によって決まるのですか?
経済理論では、医薬品の価格は需要と供給の相互作用によって決定され、顧客の購買意欲と生産者の販売意欲が一致する値で落ち着くと考えられています。
簡単に言うと、製薬会社は、研究開発にかかる多額の費用を含むコストを確実に回収し、利益を最大化するために、製品ポートフォリオ全体で価格を設定したいと考えるでしょう。異なる国での潜在的な販売量や、地域によって価格が異なるかどうかも考慮されるでしょう。また、代替治療の存在、ジェネリック医薬品の開発(特に特許制度が比較的緩やかな国の場合)、特定の法域に存在しうる価格規制や入札規制の存在に留意する(3)。
医療制度に代わって医薬品を購入する側は、患者さんが既存薬や新薬にアクセスできるようにする一方で、できるだけ安い価格で購入できるようにしたいと思うはずです。製薬会社が成功することは彼らの利益であるが、個々の会社が市場力を利用して「超利益」を生み出すことを奨励することはない。医薬品の使用を承認した保険会社や政府は、関連する集団に対する医薬品の利益を考慮し、その医薬品について可能な限り低い価格を実現することを目指すでしょう。
イングランドのNHSには、医療システムに対する新薬の価値を評価することを役割とする独立行政法人があります。NICE(National Insitute for Health and Care Excellence)は、新しい治療法の価値を評価するために、世界に影響を与えるツールや方法論を開発しました。NICEが新薬の価格を決めるわけではありませんが、英国(およびNICEの勧告を価値の基準としている他の国)で新薬を発売しようとする製薬会社は、価格戦略においてNICEが行った価値計算を考慮することになります。
ヘルス・テクノロジー・アセスメント
NICEが新しい治療法の価値を評価するために使用するツールや方法論は、医療技術評価(またはHTA)の一例です。医療技術評価(HTA)は、新しい治療法、特に医薬品の価値を評価するために、世界中の国々でますます利用されています。世界保健機関(WHO )は、HTAの能力を高め、一貫性のある体系的で学際的なアプローチを採用する上で、主導的な役割を果たしています。
HTAでは、医薬品(またはその他の治療法)の性能を代替品と比較する。性能の問題には、結果に対する薬剤の効果(治療効果)、潜在的な副作用やその他の影響、生活の質への影響、薬剤の投与方法などの評価が含まれます。これには、臨床試験などのエビデンスやその他の発表された研究のレビューが含まれ、多くの場合、結果を解釈し、エビデンスを評価するために、専門家による聞き取り調査が行われることになる。
医療費の支払いを担当する多くの組織が情報を共有し、評価プロセスの一環として他者からの証拠を喜んで受け入れています。その良い例が、EU加盟国間での協力です。しかし、評価そのものは、意思決定機関や地域の状況において何が重要であるかに大きく左右されます。
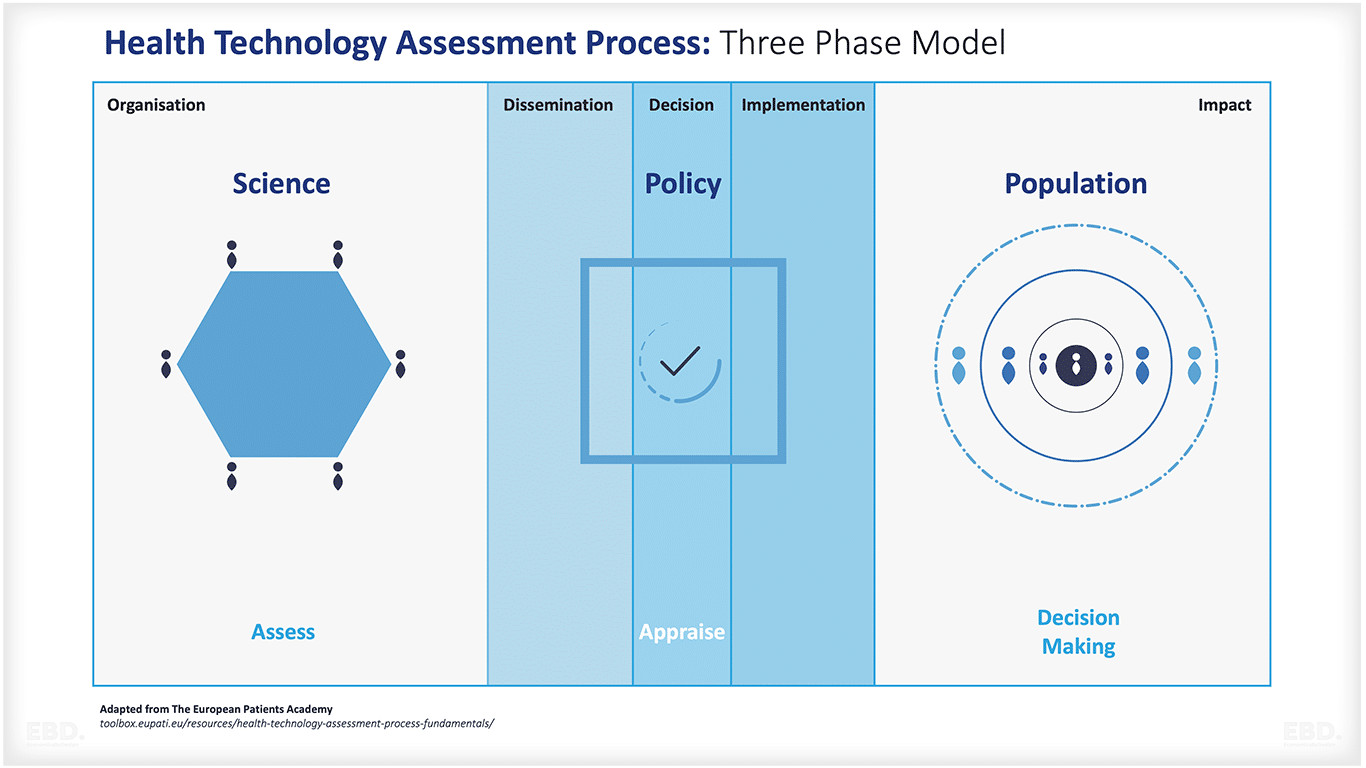
NICEが用いるような経済価値では、費用と便益の比較が行われる。患者さんへの便益を測るためにQALY(Quality Adjusted Life Year)などの効用尺度が用いられ、価値評価はQALYあたりのコストに基づいて行われます。ここでの価値は、移動、セルフケア、通常の活動、痛み・不快感、不安・抑うつへの影響に基づいて測定されます。時には、薬剤がコスト削減につながることもあります。言い換えれば、代替品よりも安く(医療システムコストの影響を考慮した上で)、より多くの利益(正のQALY値)をもたらすということです。しかし、多くの場合、新しい治療法はコストを増加させる。意思決定者は、医薬品が高価すぎると判断される前に、どの程度の閾値を設けるべきかについて判断する必要がある。経済学的手法とQALYの詳細については、こちらをご覧ください。
特定の医薬品を医療給付パッケージの一部として組み入れ、患者が利用できるようにするかどうかの決定には、より広い範囲の利害関係者が参加し、財政や予算、価格に関するより広い考慮も含まれます。この段階は、しばしば医療技術評価(評価とは異なる)と呼ばれます。
製薬会社が直面する5大課題とは?
製薬会社が直面する課題は数多くあります。ここでは、業界全体が直面する主な5つの課題を紹介します。
世界各国での規制の違い
国によって製品規制や価格規制は異なり、医薬品の認可、医薬品の価値評価、市場アクセスの提供に関するプロセスも異なります。そのすべてを最新に保ち、遵守することは困難です。
包括的な規制システムは、実験室から発売後まで医薬品を監視し、製品が安全で効果的であること、安全性の問題や副作用がよく理解され、危害のリスクを軽減できるようにすることを目的としています。
世界保健機関(WHO)は、国民を保護すると同時に、製品へのアクセスや技術革新を可能にする環境を提供するため、世界的に一貫した調和のとれた規制要件を開発する戦略を策定しました。
研究開発費の増加
新薬の開発には高いコストがかかるため、企業はどの薬に投資し、最終的に発売される製品の価格設定で頓挫したコストをどのようにカバーするかを慎重に検討する必要があります。前臨床試験から承認に至る医薬品は、わずか7.8%に過ぎません。これは、商業的な発売まで至らない製品に費やされる膨大なリソースです。
研究開発のコストを削減するのに役立ちそうなイノベーションがあります。例えば、デジタルヘルスデータ(リアルワールドデータとも呼ばれる)を利用することで、研究の焦点化、臨床試験のコスト削減、発売後の重要なモニタリング情報を提供することができます。また、デジタルツールは、臨床試験の参加者をより効率的に募集したり、ツール、デバイス、インプラントを通じてより費用対効果の高い監視やモニタリングを可能にする価値がある。
政府やその他の関係者は、特にアンメットニーズやCOVID-19のパンデミックのような緊急の健康上の問題に対処する必要がある場合、新薬の研究開発に補助金を出したり支援したりすることがよくあります。
競争の激化
業界はますます混雑し、各社が市場シェアを競っているため、競争に打ち勝つために提携や合併などの新たな取り組みが行われています。政府は、一握りの企業だけが主要な治療薬クラスで独占的に市場を支配するリスクを軽減するために、医薬品業界の競争を確保することをますます求めています。
これは、市場を歪めるような合併やその他の協力関係をコントロールする形で行われます。例えば、欧州委員会は、製薬会社が過剰な市場力を獲得するのを防ぐため、製薬会社に関連した厳しい競争政策を実施しています。
模倣品と価格破壊
偽造医薬品は、企業の収益だけでなく、公衆衛生にも影響を及ぼすため、対処が必要な問題が増えています。推定によると、偽造医薬品の世界市場は432億米ドルに達する可能性があります(2)。偽造品とジェネリック医薬品やバイオシミラーを混同しないことが重要である。
ジェネリック医薬品とバイオシミラー医薬品は規制されており、安全で効果的です。偽造品とは、虚偽のラベルが貼られ、成分の量が間違っている製品のことです。偽造品は、インターネット、露店、薬局や病院でも見つけることができます。
スキル不足
業界は熟練した科学者の不足に直面しており、業界全体に著しい「人材格差」があるとの報告も あります。自動化とテクノロジーはこうしたリスクを軽減するのに役立ちますが、一般的には、熟練した労働力の不足はコストの上昇を招き、コストの上昇は医薬品の価格と入手性に影響を及ぼします。
医薬品の経済価値とは
医薬品の経済的価値は、医薬品が社会にもたらす利益という観点から測定されます。医薬品は、人々がより健康で長生きし、病気による苦しみを軽減し、生活の質を向上させるのに役立っています。
製薬業界は経済にも貢献しています。製薬会社は主要な雇用主であり、そのサプライチェーン全体でさらなる雇用を刺激しています。
世界の医薬品産業は、世界の国内総生産(GDP)に5,320億米ドル(1%)の直接貢献をしたと推定されています。また、550万人以上の従業員を雇用し、さらにサプライチェーン全体で4500万人の雇用を促進し、その多くが発展途上国である(4)。
とはいえ、製薬会社の収益性は、研究開発費を考慮しても、同規模の企業(5社)と比べて相対的に高い。製薬産業が思うように機能しているかどうかについては、現在も議論が続いている。
「公衆衛生よりも利益を追求する製薬部門は、高い価格を設定し、株主に短期的な利益をもたらすインセンティブを与えられており、むしろ、極めて必要な治療の進歩につながる、よりリスクの高い長期的な研究に焦点を合わせています。医薬品の高価格は、世界中で患者さんのアクセスに深刻な問題を引き起こし、人々の健康と福祉に有害な影響を及ぼしています。 (6)
参考文献
(1) IQVIA 2023年1月18日。世界の医薬品市場の売上高 2001~2022年(単位:億米ドル) In Statista 2023年5月01日取得、https://www.statista.com/statistics/263102/pharmaceutical-market-worldwide-revenue-since-2001。
(2) Ofori-Parku SS.世界的な偽造医薬品の課題との戦い:米国における消費者目線のコミュニケーション戦略は必須である。J Glob Health.2022 Apr 23;12:03018. doi: 10.7189/jogh.12.03018.pmcid: pmc9031510.
(3) Janssen Daalen JM, den Ambtman A, Van Houdenhoven M, et alDeterminantsof drug prices: a systematic review of comparison studiesBMJ Open 2021;11:e046917.doi: 10.1136/bmjopen-2020-046917
(4) Prof. Dr. Dennis Ostwald, Dr. Marcus Cramer, Nora Albu, Jasmin Tesch:"The Global Economic Impact of the Pharmaceutical Industry" 2020年9月。
(5) Ledley FD, McCoy SS, Vaughan G, Cleary EG.大製薬会社の収益性と他の大公開会社の比較。JAMA.2020 Mar 3;323(9):834-843. doi: 10.1001/jama.2020.0442.PMID: 32125401; PMCID: PMC7054843.
(6) UCL Institute for Innovation and Public Purpose.The people's prescription: re-imagining health innovation to deliver public value.2018.www.ucl.ac.uk/bartlett/public-purpose/sites/public-purpose/files/peoples_prescription_report_final_online.pdf.