Mengapa ada Penelitian dan Pengembangan di bidang Kesehatan?
Penelitian dan pengembangan kesehatan sangat penting bagi sektor kesehatan. Hal ini memberikan para praktisi klinis dan investor sistem kesehatan dengan inovasi dan bukti terkait untuk intervensi pencegahan, perawatan yang efektif dan jalur perawatan.
Dalam lensa ekonomi ini, kami memberikan gambaran umum tentang penelitian dan pengembangan kesehatan dan perannya dalam sistem kesehatan.
Apa yang dimaksud dengan Penelitian dan Pengembangan Kesehatan?
Penelitian dan pengembangan pada dasarnya adalah tentang mengidentifikasi kebutuhan atau masalah, menghasilkan ide atau solusi, mengubah ide tersebut menjadi produk atau layanan, menguji produk atau layanan untuk kemanjuran, efektivitas, dan nilai, meluncurkan produk atau layanan, terus memantau, mengevaluasi, dan meningkatkan produk atau layanan, dan akhirnya menghentikan produk atau layanan ketika sudah tidak digunakan lagi.
Biasanya, produk mencakup perangkat medis, obat-obatan dan vaksin, solusi terapi gen, alat diagnostik. Produk ini juga dapat mencakup layanan dan jalur perawatan termasuk pencegahan, pengobatan dan perawatan, serta rehabilitasi.
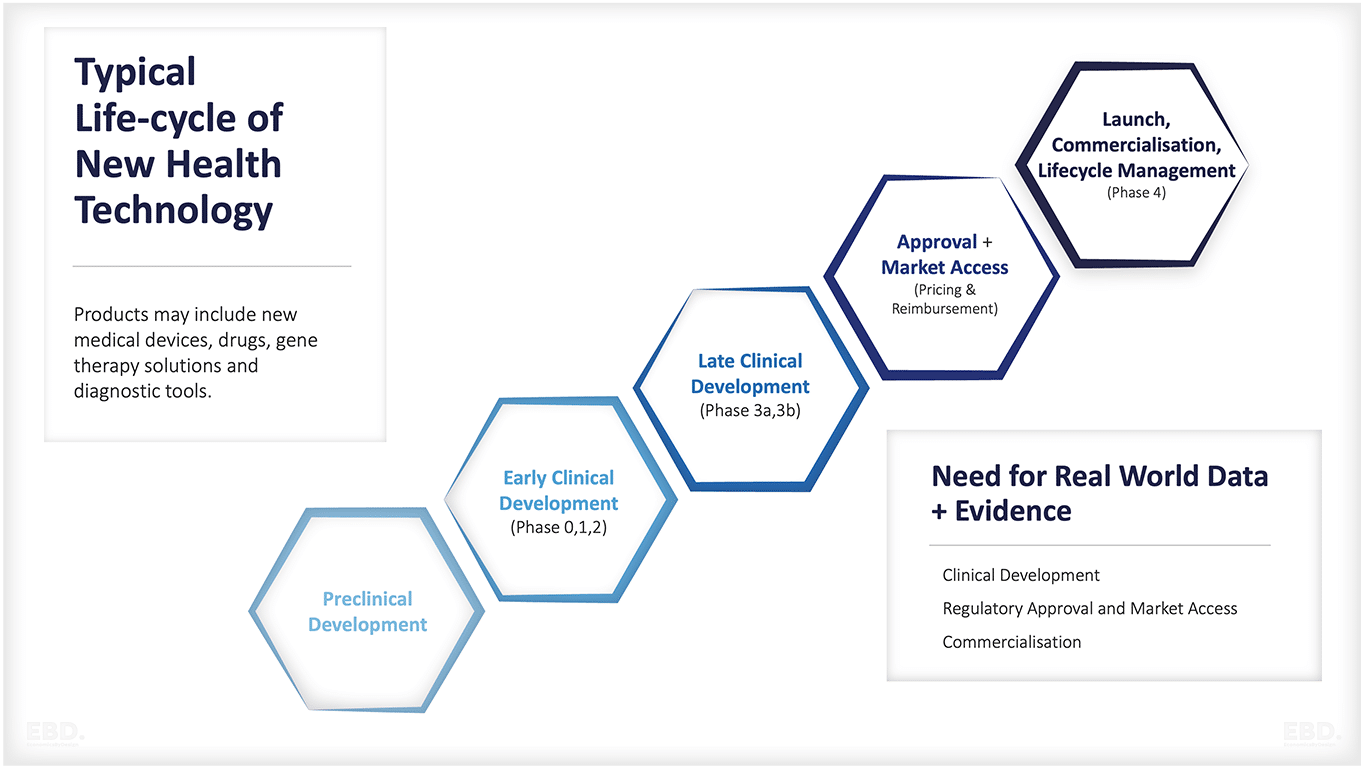
Tahapan utama dari penelitian dan pengembangan kesehatan adalah:
Pengembangan pra-klinis
Ini mencakup semua kegiatan yang terjadi sebelum produk atau layanan diuji pada manusia. Untuk intervensi klinis seperti obat-obatan, peralatan medis, terapi gen, alat diagnostik, dan sebagainya, hal ini mencakup pengujian kelayakan, pengujian keamanan, dan sebagainya, yang sering kali dilakukan di laboratorium.
Beberapa pengembangan pra-klinis dilakukan dengan menggunakan hewan. Pengujian in vitro dilakukan "di luar tubuh" atau "di luar konteks biologis normal" misalnya di dalam tabung reaksi atau cawan petri. In vivo adalah ketika pengujian dilakukan "di dalam makhluk hidup" dan, dalam kasus pengembangan pra-klinis, ini adalah pengujian pada hewan.
Seringkali pengembangan pra-klinis dapat mencakup apa yang dikenal sebagai "studi observasional". Ini adalah saat status kesehatan suatu populasi atau subkelompok populasi dipantau untuk mengidentifikasi di mana ada masalah, dan di mana intervensi pencegahan dan pengobatan dapat bekerja.
Perkembangan klinis awal
Ini adalah saat pengujian dilakukan pada manusia. Biasanya, pada tahap awal ini, obat atau perangkat diuji keamanan atau dosisnya dan untuk melihat bagaimana intervensi klinis berdampak pada manusia. Tahap ini sering kali melibatkan uji klinis "tahap 0, 1, dan 2" yang merupakan studi penelitian yang menguji dampak produk atau layanan pada manusia. Tahap uji coba umumnya mencerminkan jumlah peserta yang meningkat seiring dengan semakin banyaknya hal yang dipelajari tentang dosis, keamanan, dan efek samping.
Perkembangan klinis yang terlambat
Ini adalah tahap di mana produk atau layanan diuji dalam skala besar pada suatu populasi. Uji coba tahap 3 ini rumit, memakan waktu, dan seringkali mahal. Uji coba ini bertujuan untuk menguji dampak produk atau layanan terhadap hasil kesehatan.
Penting untuk mengisolasi dampak produk atau layanan dari faktor-faktor lain yang secara independen menjelaskan perubahan hasil kesehatan. Karena alasan ini, uji klinis tahap 3 sering kali dirancang sebagai uji coba terkontrol secara acak (RCT).
RCT melibatkan pengalokasian peserta uji coba secara acak ke dalam kelompok yang berbeda, mereka yang menerima intervensi (kelompok perlakuan) dan mereka yang tidak menerima intervensi (kelompok kontrol). Seringkali hal ini dilakukan secara "buta" sehingga peserta tidak mengetahui apakah mereka menerima intervensi atau tidak. Dalam kasus obat, mereka mungkin, misalnya, menerima "plasebo" (pengobatan tanpa nilai terapeutik).
Terkadang, uji coba tahap 3 dapat bersifat "double-blind" di mana praktisi kesehatan yang memberikan intervensi tidak mengetahui peserta mana yang menerima pengobatan atau plasebo.
Jika populasi uji coba mewakili populasi umum atau populasi target untuk pengobatan, maka proses RCT dapat memastikan bahwa semua faktor yang dapat memengaruhi hasil kesehatan (seperti usia, kondisi kesehatan lain, kebugaran, dll.) sama-sama mungkin mengganggu kelompok perlakuan dan kelompok kontrol sehingga dapat diabaikan. Satu-satunya alasan untuk hasil kesehatan yang berbeda antara kelompok perlakuan dan kelompok kontrol adalah nilai terapeutik dari produk atau layanan.
Dalam praktiknya, sangat sulit dan/atau mahal untuk merancang RCT sehingga sering kali, uji coba tahap 3 menggunakan teknik lain untuk meminimalkan risiko apa yang dikenal sebagai "bias atribusi", yaitu perbedaan hasil yang diamati pada kelompok perlakuan yang secara keliru dikaitkan dengan produk atau layanan.
Yang penting, jika produk atau layanan memerlukan persetujuan dari regulator, uji klinis tahap 3 biasanya dilakukan setelah permohonan persetujuan regulator diajukan, tetapi sebelum persetujuan diberikan.
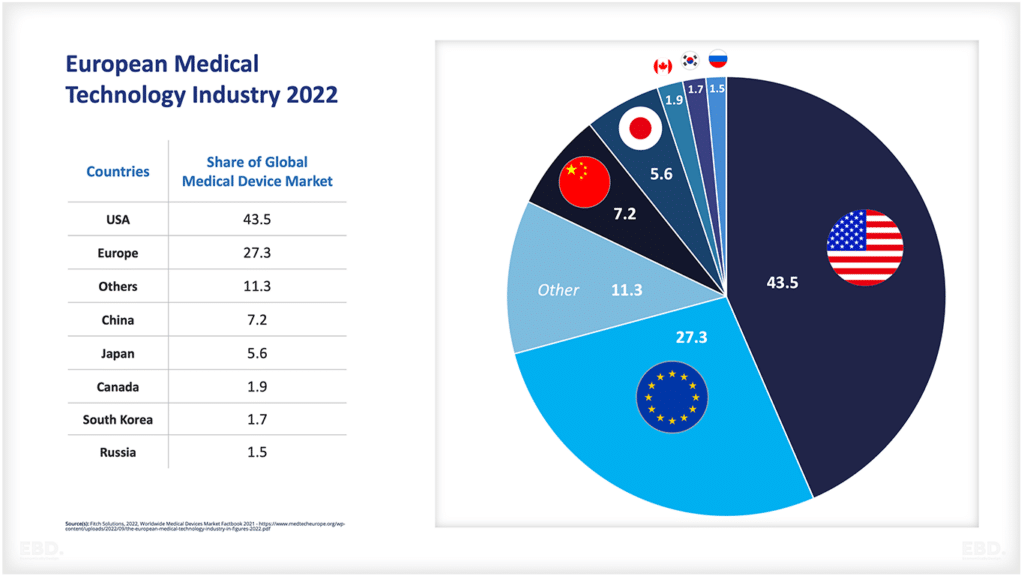
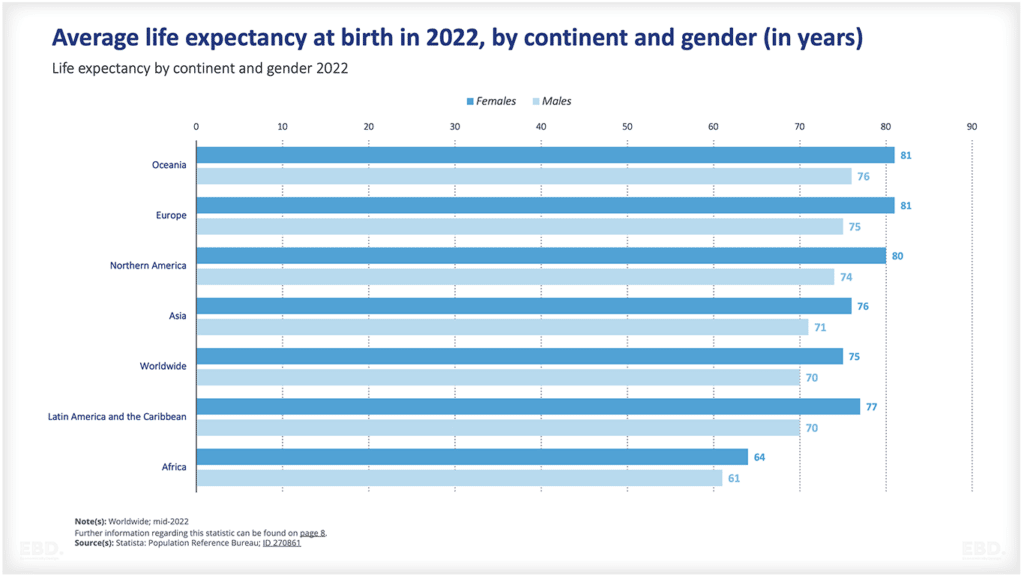
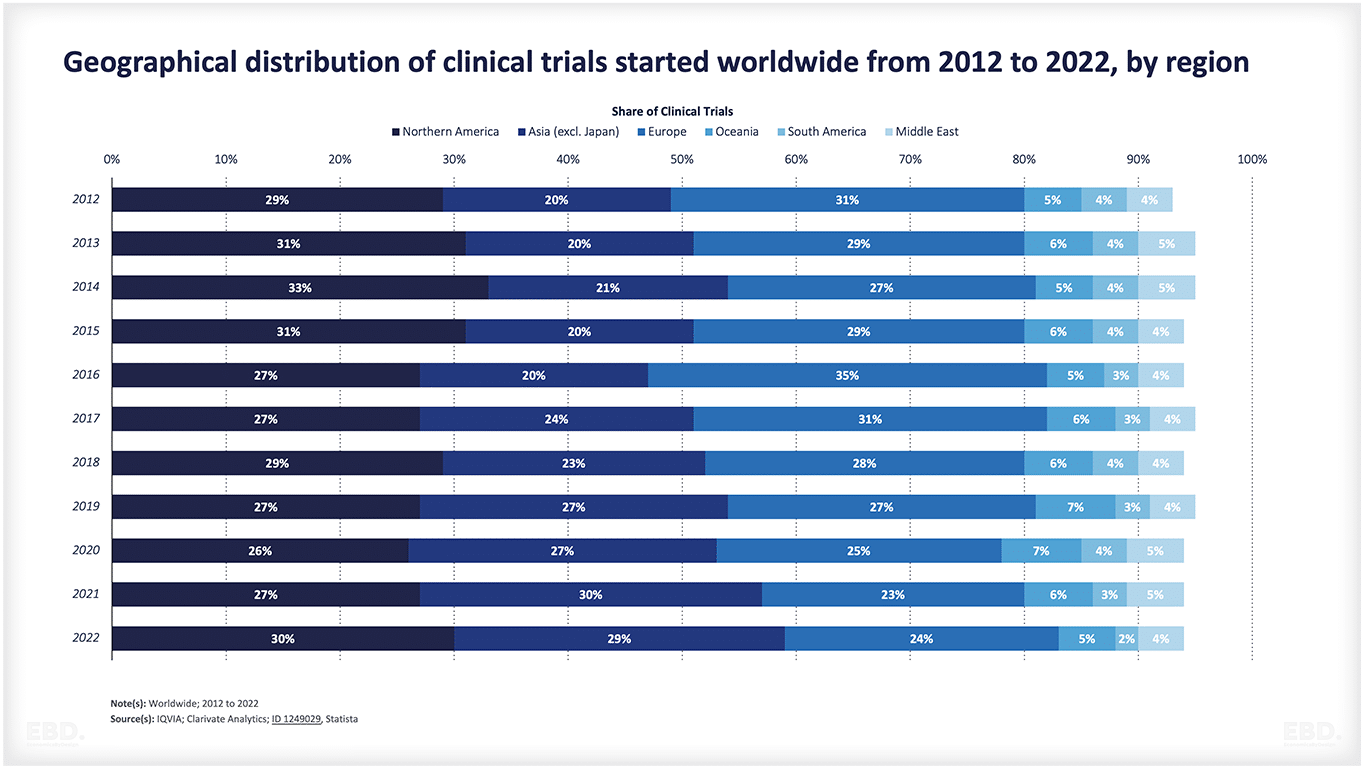
Bagan di bawah ini menunjukkan bahwa, saat ini, sebagian besar uji klinis dilakukan di Amerika Utara, Asia dan Eropa.
Otorisasi Pasar, Penetapan Harga dan Penggantian Biaya
Tahap ini adalah tahap di mana produk atau layanan disetujui oleh badan pengatur yang relevan (jika diperlukan) dan saat keputusan harga dan penggantian biaya dibuat dengan mereka yang bertanggung jawab untuk membayar atau menugaskan perawatan kesehatan atas nama suatu populasi.
Tahap ini sering kali membutuhkan informasi tambahan yang harus dikumpulkan, dan khususnya data ekonomi untuk menunjukkan nilai produk atau layanan. Hal ini sering dikenal sebagai Penilaian Teknologi Kesehatan (Health Technology Appraisal/HTA). Organisasi yang telah mengembangkan produk atau layanan akan diminta untuk menyerahkan data untuk mendukung proses ini dan pembayar akan menugaskan ahli independen untuk melakukan HTA.
Untuk beberapa pembayar, ada tolok ukur atau pedoman yang jelas terkait dengan efektivitas dan nilai yang harus dicapai jika produk atau layanan akan dimasukkan dalam paket manfaat kesehatan. Bagi yang lain, keputusan diambil berdasarkan kasus per kasus. Sering kali keputusan untuk memasukkan produk atau layanan sebagai bagian dari manfaat kesehatan esensial diambil berdasarkan saran dari komite spesialis yang terdiri dari para ahli di bidangnya serta perwakilan pasien.
Semakin banyak pembayar dan regulator yang mengaitkan persetujuan, penetapan harga, dan penggantian biaya dengan persyaratan bahwa produk atau layanan harus melalui beberapa pengumpulan data tambahan dan persyaratan pengawasan untuk memastikan efektivitas dan nilai.
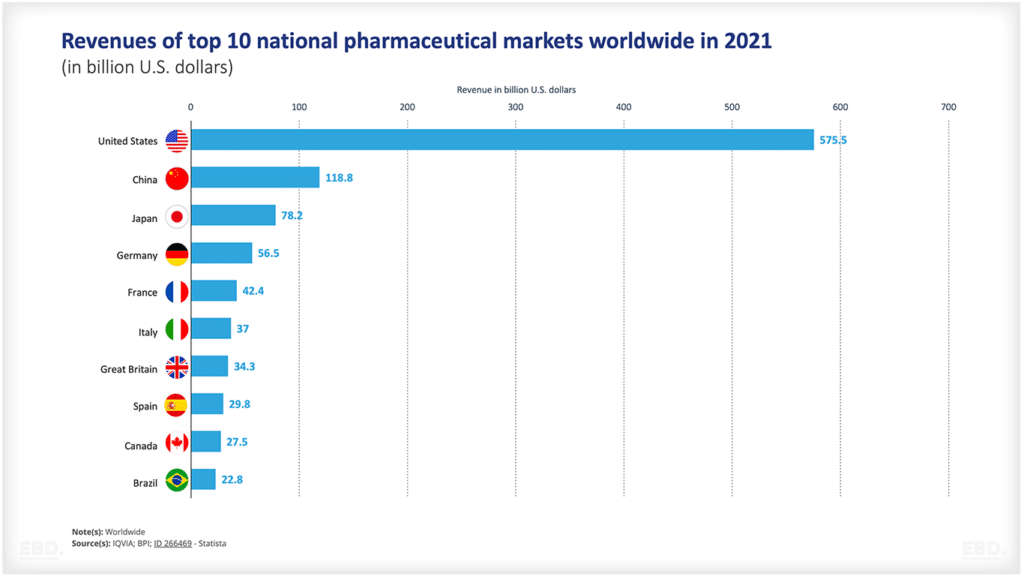
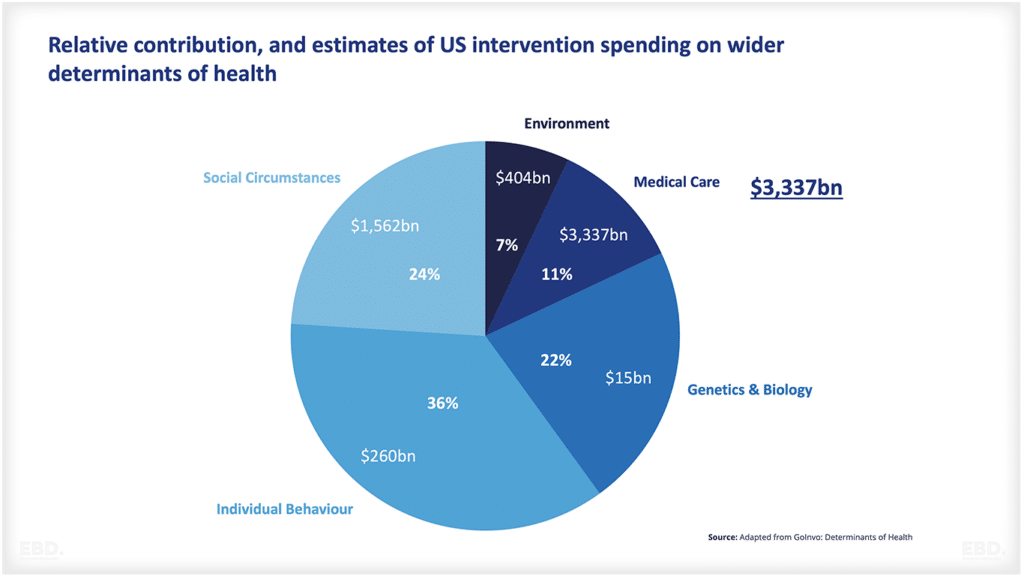
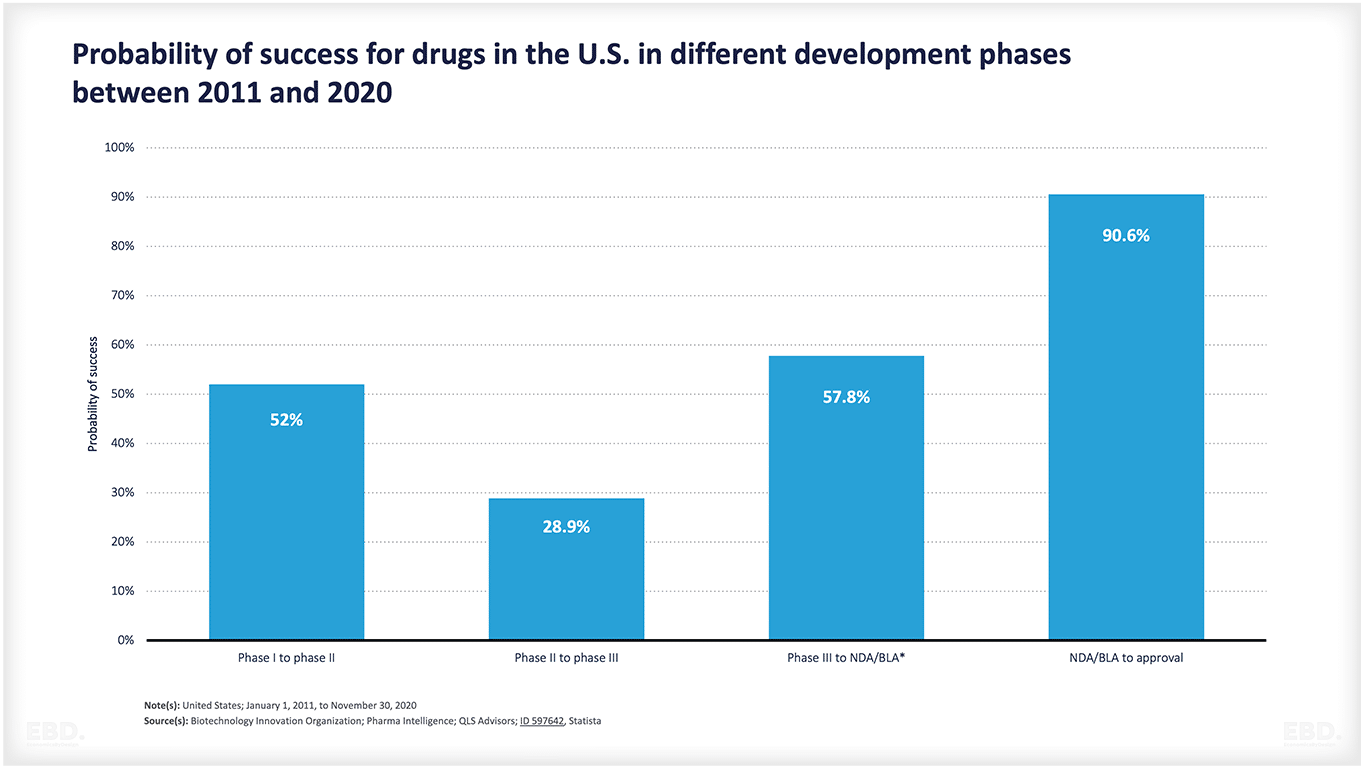
Seperti yang ditunjukkan oleh bagan di bawah ini, banyak produk yang tidak berhasil melewati tahap konsepsi hingga persetujuan. Ada banyak ketidakpastian ilmiah atau teknologi yang terlibat. Bagan ini menunjukkan bahwa untuk obat-obatan di Amerika Serikat, sekitar separuhnya berpindah dari tahap 1 ke tahap 2 dan sekitar 29% berpindah dari tahap 2 ke tahap 3. Lebih dari setengahnya kemudian beralih ke tahap akses pasar dan, jika sampai di sana, lebih dari 90% disetujui. Namun, secara kolektif, hanya 7,8% obat yang berpindah dari tahap pra-klinis ke tahap persetujuan. Itu adalah jumlah sumber daya yang sangat besar yang dikhususkan untuk produk yang tidak berhasil mencapai peluncuran komersial.
Peluncuran, Komersialisasi, Manajemen Siklus Hidup
Fase ini mencakup semua kegiatan penelitian dan pengembangan yang berkaitan dengan produk atau layanan kesehatan setelah produk atau layanan tersebut diadopsi untuk digunakan di seluruh populasi. Kegiatan di sini meliputi pemantauan keamanan dan efek samping, pemantauan dampak, dan juga mengumpulkan bukti dunia nyata untuk menginformasikan keputusan apakah produk tersebut dapat memperluas cakupan populasinya atau jenis kondisi kesehatan yang dapat ditolong.
Apa Itu Data dan Bukti Dunia Nyata?
Semakin banyak pemangku kepentingan penelitian dan pengembangan dalam sistem kesehatan yang mulai menggunakan data dan bukti dunia nyata untuk mengambil keputusan. Data dunia nyata adalah data yang dikumpulkan secara rutin dari dalam sistem kesehatan dan di luarnya. Bukti dunia nyata didasarkan pada analisis data dunia nyata.
Potensi penggunaan data dan bukti dunia nyata meliputi:
Pengembangan Klinis
- Memprioritaskan pengembangan klinis awal
- Mempelajari penyakit dan bebannya
- Untuk mempelajari penyakit Manajemen
- Desain Uji Klinis
- Pelaksanaan Uji Coba Meningkatkan efisiensi perekrutan pasien
Persetujuan Regulasi + Akses Pasar
- Memfasilitasi Proses Regulasi
- Memfasilitasi Penetapan Harga, Penggantian Biaya, dan Akses Pasar
Komersialisasi
- Memberikan wawasan ilmiah dan klinis yang baru
- Memberikan Wawasan Komersial dan Bisnis
- Mendukung program komersial
- Memfasilitasi pengawasan dan farmakovigilans pasca-pemasaran
- Optimalisasi Manajemen Pasien
- Perluasan indikasi
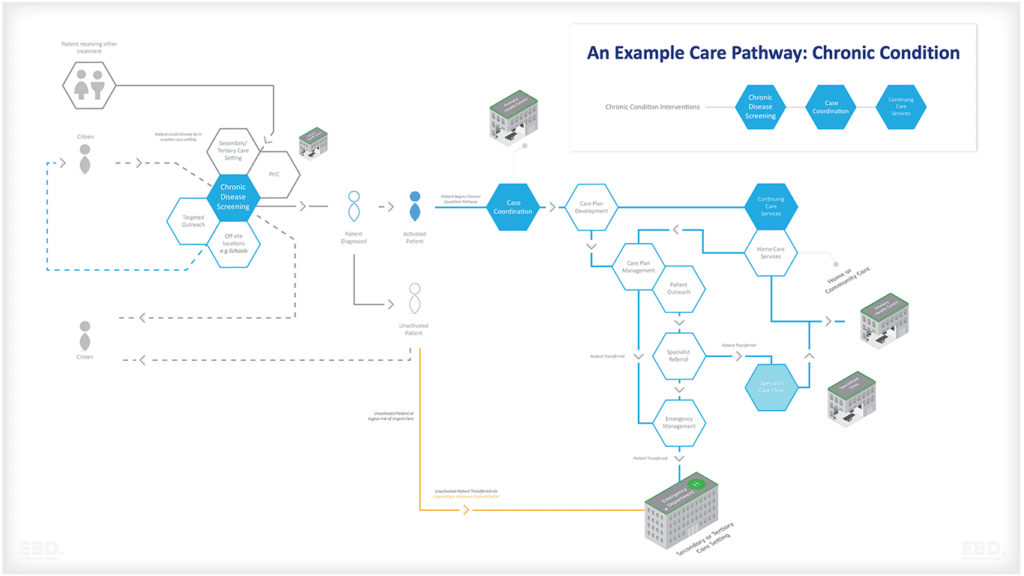
Gambar di bawah ini memberikan ringkasan jenis masalah di mana data dunia nyata dapat mendukung desain dan implementasi uji klinis yang efektif.
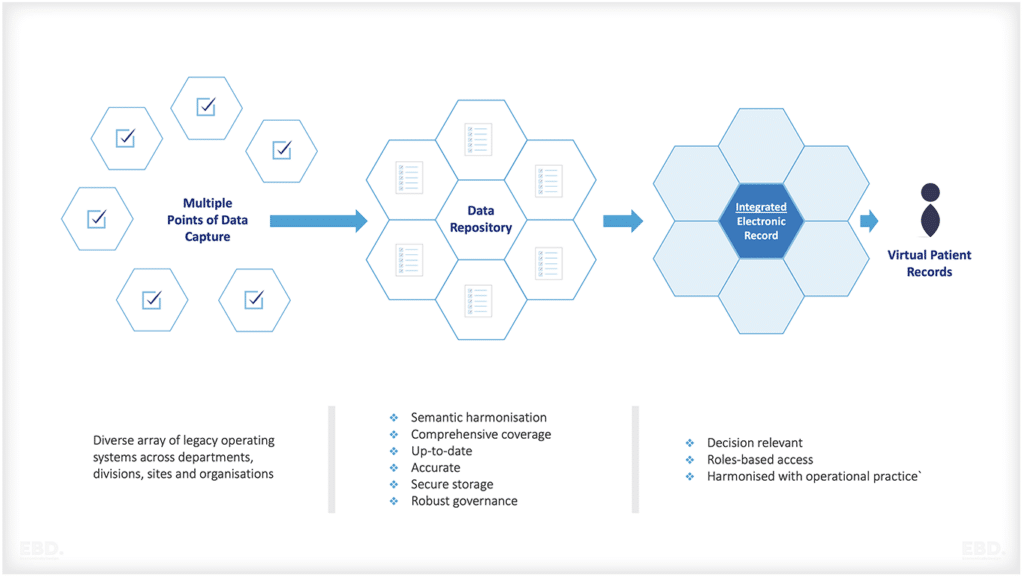
Karakteristik sumber data yang ideal untuk menghasilkan bukti dunia nyata
- Populasi pasien yang mewakili pasien dengan kondisi yang mendasari (misalnya, demografi, komorbiditas klinis)
- Direncanakan Secara Prospektif
- Terus diperbarui dengan sumber daya minimal
- Tindak lanjut longitudinal
- Tanggal klinis yang kaya: dokter dimasukkan, pasien dilaporkan, dan pasien dihasilkan
- Langkah-langkah pengendalian kualitas yang diterapkan
- Terintegrasi dalam sistem data yang ada
Ada beberapa tantangan dengan data dunia nyata. Data ini dapat memiliki kualitas yang bervariasi dalam hal akurasi, dan mungkin juga hanya mencakup sebagian. Data dunia nyata belum tentu teratur atau tepat waktu, dan mungkin tidak memberikan informasi yang komprehensif di semua bidang yang diminati. Namun, seiring dengan semakin berkembangnya kemampuan digital dari sistem kesehatan, isu-isu ini menjadi kurang menjadi hambatan bagi penggunaan bukti dunia nyata oleh komunitas penelitian dan pengembangan.
Apa yang Dimaksud dengan Tata Kelola Penelitian?
Penelitian dan pengembangan dalam bidang kesehatan menghadirkan banyak masalah etika. Peserta penelitian diminta untuk menjadi tempat uji coba bagi manusia untuk produk dan layanan baru yang mungkin tidak berhasil, atau lebih buruk lagi, dapat membahayakan. Mereka sering diminta untuk berpartisipasi karena mereka hidup dengan suatu kondisi atau penyakit. Mereka juga diminta untuk memberikan data dan informasi yang sangat pribadi kepada tim peneliti.
Tata kelola penelitian didefinisikan sebagai peraturan, aturan, prinsip dan standar yang memastikan dan menjamin penelitian yang berkualitas tinggi. Tata kelola penelitian yang dirancang dengan baik harus memberikan jaminan kepada semua pemangku kepentingan bahwa penelitian dilakukan dengan standar kualitas yang disyaratkan, memiliki tujuan dan nilai, dan bahwa standar partisipasi, perlindungan peserta dan peneliti, serta pembagian informasi ditaati.
Tata kelola penelitian juga harus memungkinkan pemantauan kinerja dan berbagi praktik-praktik yang baik dalam perawatan kesehatan, tata kelola penelitian mencakup semua penelitian yang berhubungan dengan kesehatan yang melibatkan manusia, jaringan atau data mereka.
Pengaturan tata kelola penelitian bervariasi di seluruh dunia. Di beberapa negara, terdapat pengaturan yang kuat dan persetujuan diperlukan untuk semua penelitian yang melibatkan manusia, jaringan atau data mereka. Persetujuan etika akan tergantung pada kualitas protokol penelitian, dan pengaturan persetujuan yang berlaku untuk peserta.
Di beberapa negara, pengaturan ini belum ditetapkan. Ketika penelitian dilakukan di negara-negara yang tidak memiliki tata kelola penelitian dan/atau di mana persetujuan etis tidak diberikan, akan sulit bagi para peneliti untuk melihat penelitian mereka dipublikasikan di jurnal yang diulas oleh rekan sejawat.
Contoh-contoh yang berguna dari pengaturan dan organisasi tata kelola penelitian meliputi:
- Peraturan Uji Klinis Eropa yang mengatur uji klinis di seluruh Komisi Eropa
- Otoritas Penelitian Kesehatan NHS memberikan kerangka kebijakan untuk praktik yang baik dalam pengelolaan dan pelaksanaan penelitian kesehatan dan perawatan sosial di Inggris
- Situs web ClinRegs milik Institut Nasional Alergi dan Penyakit Menular (NIAD) Amerika Serikat menyediakan informasi spesifik negara mengenai peraturan penelitian klinis di beberapa negara tertentu di seluruh dunia.
Berapa Banyak Investasi yang Ada Dalam Penelitian dan Pengembangan Kesehatan?
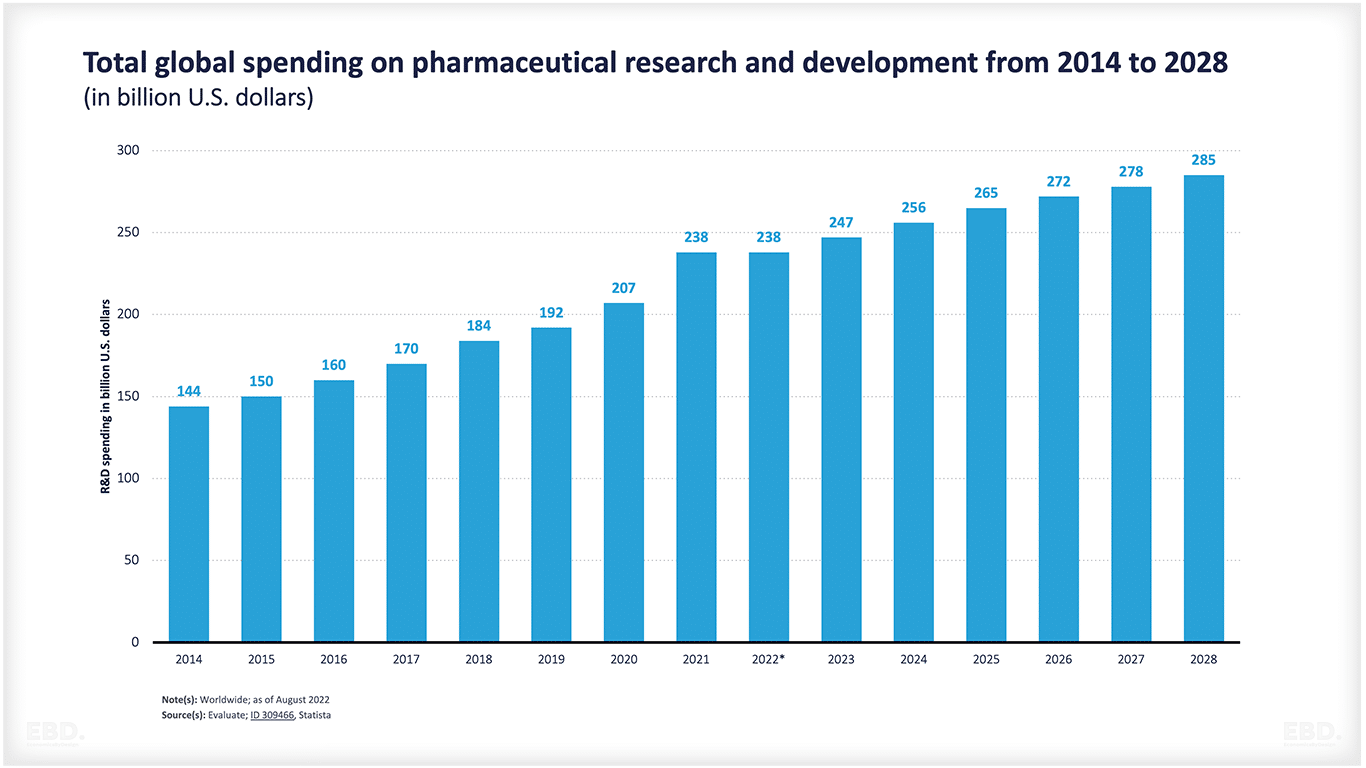
Menurut Institut Statistik UNESCO , dunia menghabiskan dana setara dengan $2,47 triliun untuk penelitian dan pengembangan pada tahun 2022. Dari jumlah tersebut, $238 miliar terkait dengan penelitian dan pengembangan farmasi dan diperkirakan akan meningkat menjadi $285 miliar pada tahun 2028.
Ada banyak pemangku kepentingan yang terlibat dalam mendanai penelitian dan pengembangan, termasuk perusahaan swasta (misalnya perusahaan farmasi, perusahaan alat kesehatan, perusahaan kesehatan digital), pemerintah melalui pemberian hibah dan penghargaan, dan melalui penyelenggaraan penelitian di penyedia layanan kesehatan yang dikelola pemerintah, dan badan amal penelitian medis.
Contoh perusahaan farmasi global terkemuka yang berinvestasi dalam penelitian dan pengembangan meliputi:
Penyandang dana filantropi teratas untuk penelitian kesehatan secara global meliputi:
- Wellcome Trust
- Howard Hughes Medical Institute
- Bill and Melinda Gates Foundation
- Insitute Pasteur
- Yayasan Oswaldo Cruz
- Yayasan Rockefeller
Siapa yang Melakukan Penelitian dan Pengembangan Kesehatan?
Sebagian besar penelitian dan pengembangan kesehatan dilakukan oleh para akademisi klinis, dokter yang didanai oleh penyandang dana penelitian, dan penyedia layanan kesehatan akademis yang menjadi tuan rumah penelitian.
Pusat Ilmu Kesehatan Akademik adalah penyedia layanan kesehatan yang menggabungkan penelitian, pendidikan, dan pemberian layanan. Contohnya meliputi:
- Johns Hopkins (Fakultas Kesehatan Masyarakat, Fakultas Keperawatan, Fakultas Kedokteran) di Amerika Serikat
- Mitra UCL diInggris
- Rumah Sakit Otak Npistanbuldi Turki
- Pusat Medis Universitas Leiden di Belanda
Apa Nilai Penelitian & Pengembangan Kesehatan yang Didanai Pemerintah?
Pemerintah mendanai penelitian dan pengembangan kesehatan untuk merangsang investasi dari sektor filantropi dan komersial, dan untuk menyediakan akses terhadap dana di daerah-daerah di mana insentif komersial relatif kurang.
Oleh karena itu, penelitian dan pengembangan kesehatan yang didanai pemerintah dapat memberikan nilai tambah, baik dengan mendorong pertumbuhan ekonomi maupun dengan mendukung peningkatan kesehatan bagi masyarakat dan individu.
Hanya ada sedikit penelitian yang tersedia untuk menunjukkan laba atas investasi dari pendanaan pemerintah untuk penelitian dan pengembangan, tetapi beberapa penelitian telah menunjukkan hasil yang positif untuk beberapa studi kasus tertentu.
- Grant J, Buxton MJ Pengembalian ekonomi untuk pendanaan penelitian medis BMJ Open 2018;8:e022131. doi: 10.1136/bmjopen-2018-022131 menunjukkan pengembalian antara 7% dan 10% dalam hal keuntungan kesehatan, dan 15% lebih lanjut dari dampak ekonomi yang lebih luas. Hal ini didasarkan pada investasi dalam penelitian kardiovaskular, kanker, dan muskuloskeletal di Inggris.
- Joyce Craig dan rekan-rekannya di University of York memperkirakan laba atas investasi dari pendanaan Pusat Penelitian Biomedis di Inggris sekitar 29%.
- Sebuah studi terbaru dari konsorsium Kings College London, RAND Europe, dan Brunel University menunjukkan laba atas investasi sekitar 25% (berdasarkan penelitian penyakit muskuloskeletal di Inggris).
Faktor terpenting yang perlu dipertimbangkan ketika melihat nilai investasi penelitian dan pengembangan di bidang kesehatan adalah bahwa hal tersebut pada dasarnya tidak pasti. Di sinilah sistem kesehatan harus siap untuk mengambil risiko dan/atau mendukung perusahaan yang siap untuk mengambil risiko.
Global Observatory on Health R&D
Salah satu sumber informasi terbaik mengenai penelitian dan pengembangan kesehatan global adalah Global Observatory on Health R&D milik Organisasi Kesehatan Dunia (WHO). Situs ini menyediakan informasi dan analisis berdasarkan sintesis data dan informasi dari seluruh dunia tentang penelitian dan pengembangan penyakit.
Ini adalah sumber daya yang sangat kaya bagi siapa saja yang ingin mengetahui apa yang sedang diteliti dan di mana kesenjangannya. Ini adalah toko serba ada bagi para peneliti di lapangan.