Pourquoi y a-t-il de la recherche et du développement dans les soins de santé ?
La recherche et le développement dans le domaine de la santé sont très importants pour le secteur de la santé. Elle fournit aux praticiens cliniques et aux investisseurs du système de santé des innovations et des preuves associées pour les interventions de prévention, les traitements efficaces et les parcours de soins.
Dans cette optique économique, nous donnons un aperçu de la recherche et du développement dans le domaine de la santé et de son rôle dans le système de santé.
Qu'est-ce que la recherche et le développement en matière de santé ?
La recherche et le développement consistent essentiellement à identifier un besoin ou un problème, à générer une idée ou une solution, à convertir cette idée en un produit ou un service, à tester l'efficacité et la valeur du produit ou du service, à lancer le produit ou le service, à continuer à surveiller, à évaluer et à améliorer le produit ou le service, et enfin à supprimer le produit ou le service lorsqu'il devient obsolète.
Les produits comprennent généralement des dispositifs médicaux, des médicaments et des vaccins, des solutions de thérapie génique et des outils de diagnostic. Ils peuvent également inclure des services et des parcours de soins, notamment la prévention, le traitement et les soins, ainsi que la réadaptation.
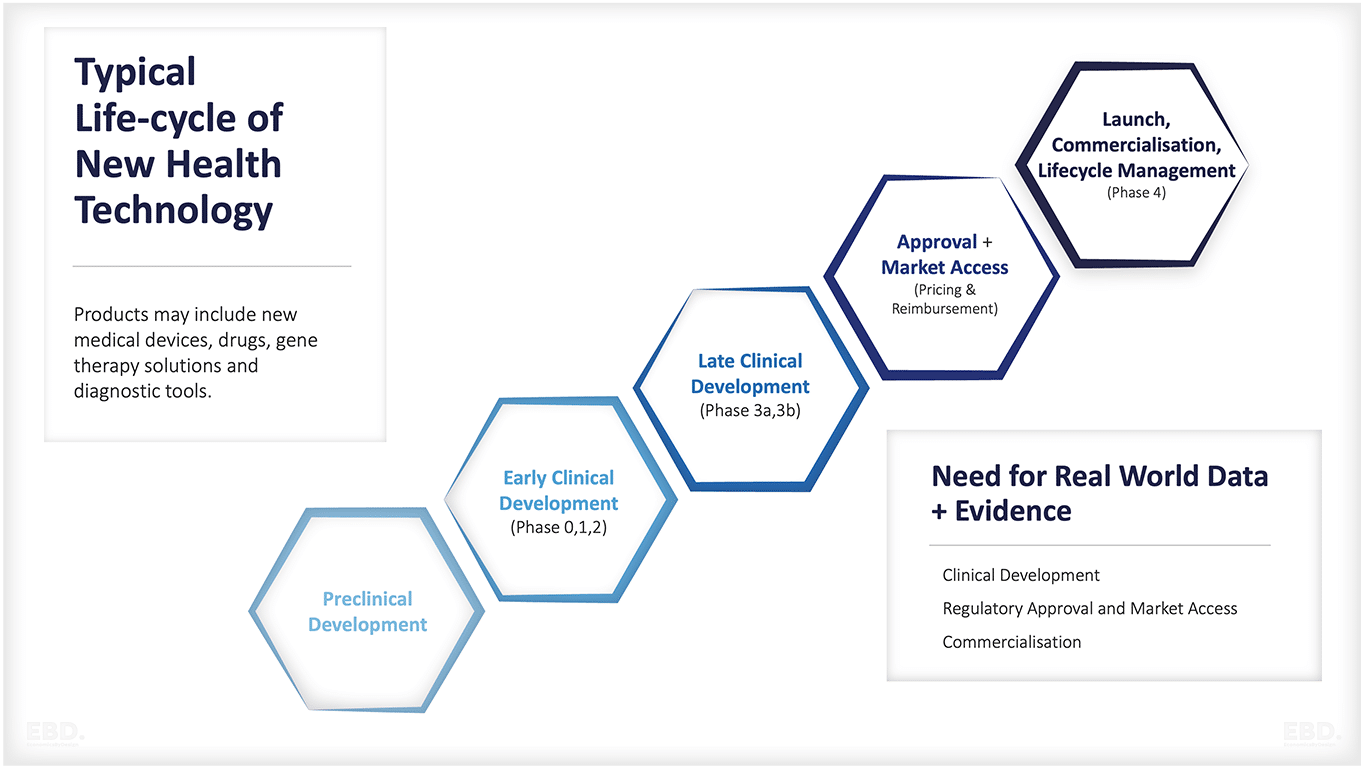
Les étapes clés de la recherche et du développement dans le domaine de la santé sont les suivantes :
Développement préclinique
Il s'agit de toutes les activités qui se déroulent avant qu'un produit ou un service ne soit testé sur des personnes. Pour les interventions cliniques telles que les médicaments, les dispositifs médicaux, la thérapie génique, les outils de diagnostic, etc., il s'agira d'essais de faisabilité, d'essais de sécurité, etc. souvent en laboratoire.
Certains développements précliniques sont effectués sur des animaux. Les tests in vitro sont effectués "en dehors du corps" ou "en dehors du contexte biologique normal", par exemple dans un tube à essai ou une boîte de Pétri. Les essais in vivo sont réalisés "dans le cadre de la vie" et, dans le cas du développement préclinique, il s'agit d'essais sur les animaux.
Souvent, le développement préclinique peut inclure ce que l'on appelle des "études d'observation". Il s'agit de surveiller l'état de santé d'une population ou d'un sous-groupe de population afin d'identifier les problèmes existants et les domaines dans lesquels les interventions de prévention et de traitement pourraient être efficaces.
Développement clinique précoce
C'est à ce moment-là que les tests sont effectués sur des personnes. En général, à ces premiers stades, le médicament ou le dispositif est testé en termes de sécurité ou de dosage et pour voir comment l'intervention clinique a un impact sur l'homme. Cette étape implique souvent des essais cliniques de "stade 0, 1 et 2", qui sont des études de recherche visant à tester l'impact d'un produit ou d'un service sur des personnes. Le stade de l'essai reflète généralement le nombre de participants, qui augmente au fur et à mesure que l'on en apprend davantage sur le dosage, la sécurité et les effets secondaires.
Développement clinique tardif
C'est à ce stade que le produit ou le service est testé à grande échelle sur une population. Ces essais de phase 3 sont complexes, longs et souvent coûteux. L'essai vise à tester l'impact du produit ou du service sur les résultats en matière de santé.
Il est important d'isoler l'impact du produit ou du service des autres facteurs qui expliquent indépendamment les changements dans les résultats de santé. C'est pourquoi les essais cliniques de phase 3 sont souvent conçus comme des essais contrôlés randomisés (ECR).
Un ECR implique la répartition aléatoire des participants à l'essai en différents groupes, ceux qui bénéficient de l'intervention (le groupe de traitement) et ceux qui n'en bénéficient pas (le groupe de contrôle). Cette répartition se fait souvent "à l'aveugle", de sorte que le participant ne sait pas s'il bénéficie ou non de l'intervention. Dans le cas d'un médicament, il peut, par exemple, recevoir un "placebo" (un traitement sans valeur thérapeutique).
Parfois, l'essai de phase 3 peut être "en double aveugle", c'est-à-dire que le praticien de santé qui délivre l'intervention ne sait pas quel participant reçoit le traitement ou le placebo.
Si la population de l'essai est représentative de la population générale ou de la population cible du traitement, le processus d'essai contrôlé randomisé peut garantir que tous les facteurs susceptibles d'influencer le résultat sanitaire (tels que l'âge, d'autres problèmes de santé, la condition physique, etc. La seule raison pour laquelle le résultat sanitaire est différent entre le groupe de traitement et le groupe de contrôle est la valeur thérapeutique du produit ou du service.
Dans la pratique, il est très difficile et/ou coûteux de concevoir des essais contrôlés randomisés et, par conséquent, les essais de phase 3 utilisent souvent d'autres techniques pour minimiser le risque de ce que l'on appelle le "biais d'attribution", à savoir que les différences observées dans les résultats pour le groupe de traitement sont attribuées par erreur au produit ou au service.
Il est important de noter que si le produit ou le service nécessite une autorisation réglementaire, les essais cliniques de phase 3 sont généralement réalisés après le dépôt d'une demande d'autorisation réglementaire, mais avant qu'elle ne soit accordée.
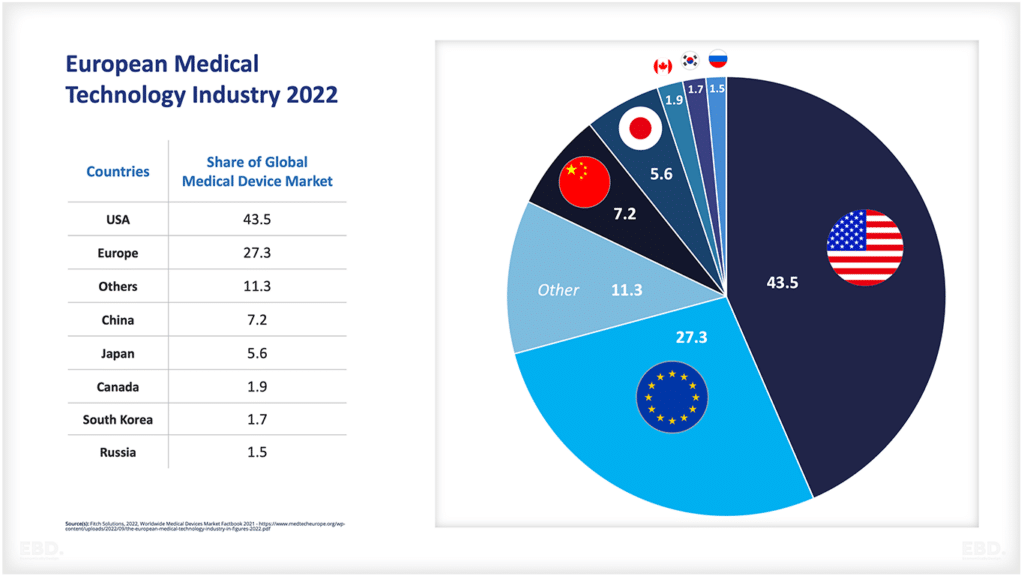
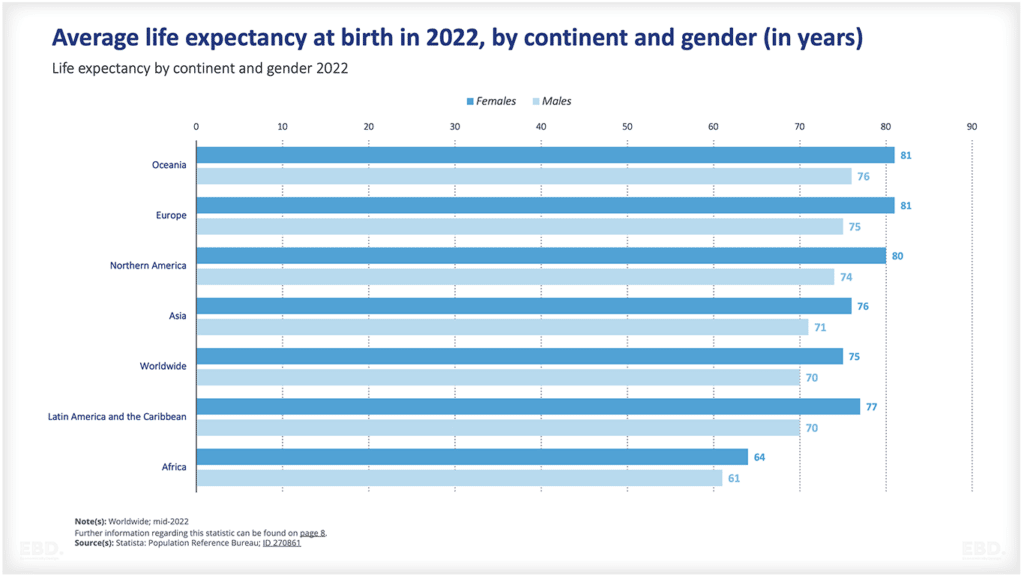
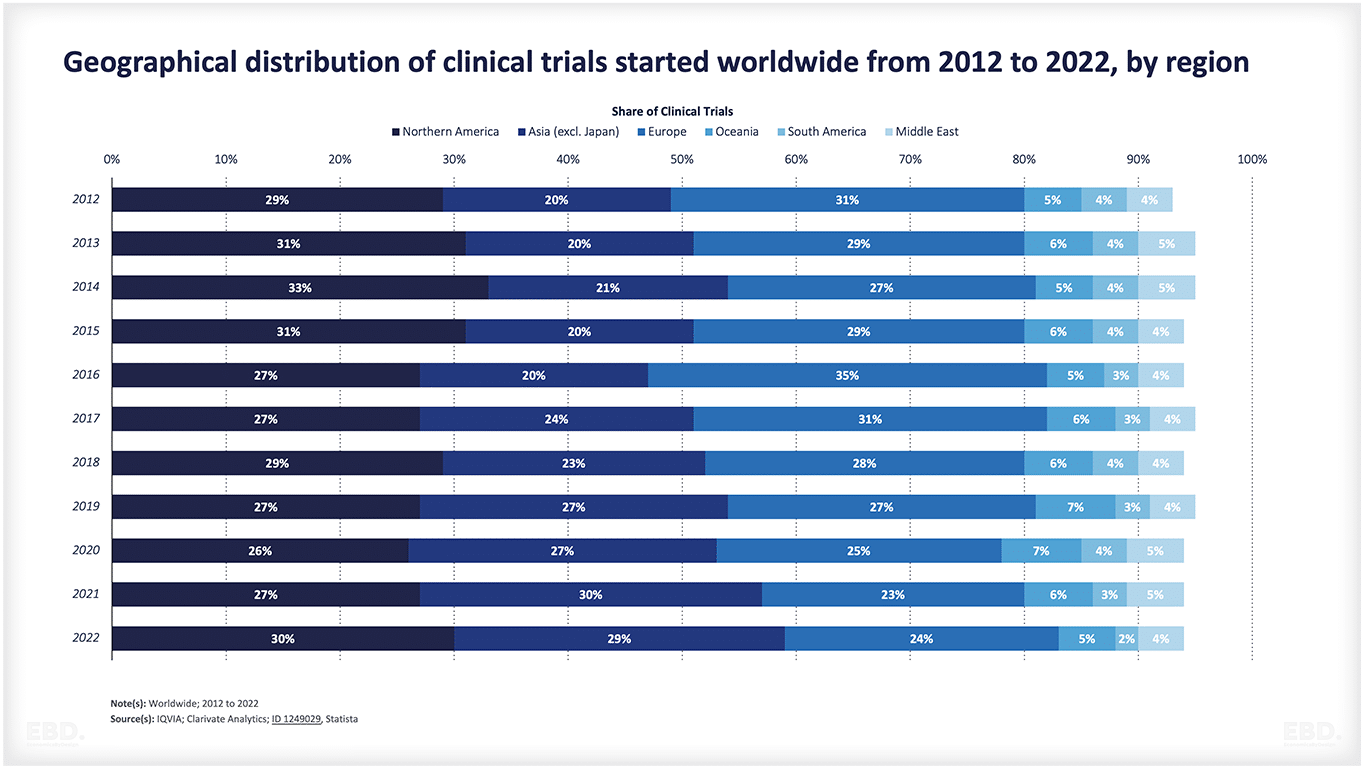
Le graphique ci-dessous montre qu'à l'heure actuelle, la grande majorité des essais cliniques sont réalisés en Amérique du Nord, en Asie et en Europe.
Autorisation de mise sur le marché, prix et remboursement
C'est à ce stade que le produit ou le service est approuvé par l'organisme de réglementation compétent (le cas échéant) et que les décisions en matière de prix et de remboursement sont prises avec les personnes chargées de payer ou de faire payer les soins de santé au nom d'une population.
Cette étape nécessite souvent la collecte d'informations supplémentaires, et en particulier de données économiques pour démontrer la valeur du produit ou du service. C'est ce qu'on appelle l'évaluation des technologies de la santé (ETS). L'organisation qui a développé le produit ou le service sera invitée à soumettre des données à l'appui de ce processus et le payeur chargera des experts indépendants d'entreprendre l'ETS.
Pour certains payeurs, il existe des références ou des lignes directrices claires en matière d'efficacité et de valeur qui doivent être respectées pour que le produit ou le service soit inclus dans l' ensemble des prestations de santé. Pour d'autres, les décisions sont prises au cas par cas. Souvent, les décisions d'inclure des produits ou des services dans les prestations de santé essentielles sont prises sur l'avis d'un comité de spécialistes composé d'experts dans le domaine et de représentants des patients.
De plus en plus, les payeurs et les régulateurs lient l'approbation, la tarification et le remboursement à l'obligation de soumettre le produit ou le service à des exigences supplémentaires en matière de collecte de données et de surveillance afin d'en garantir l'efficacité et la valeur.
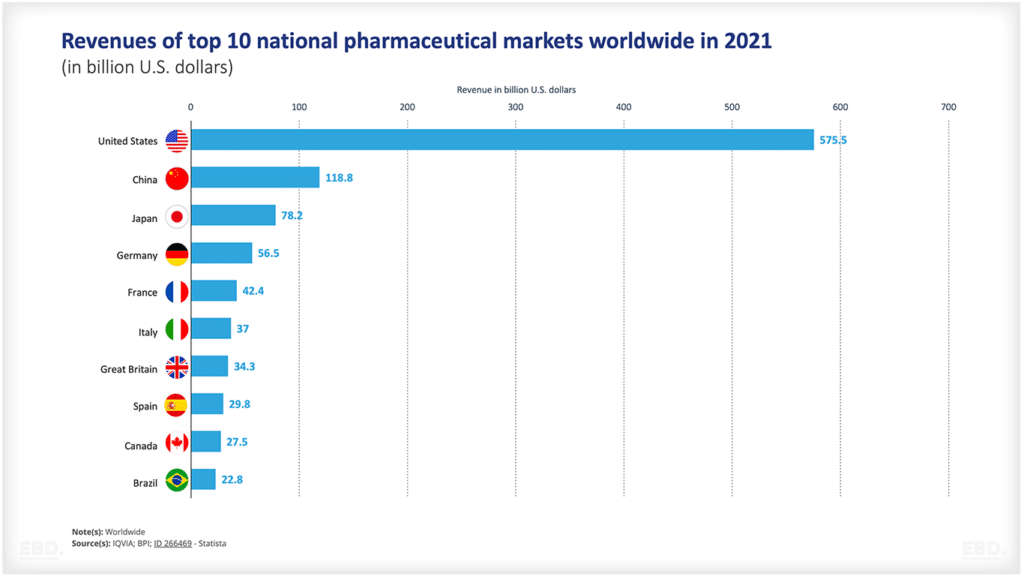
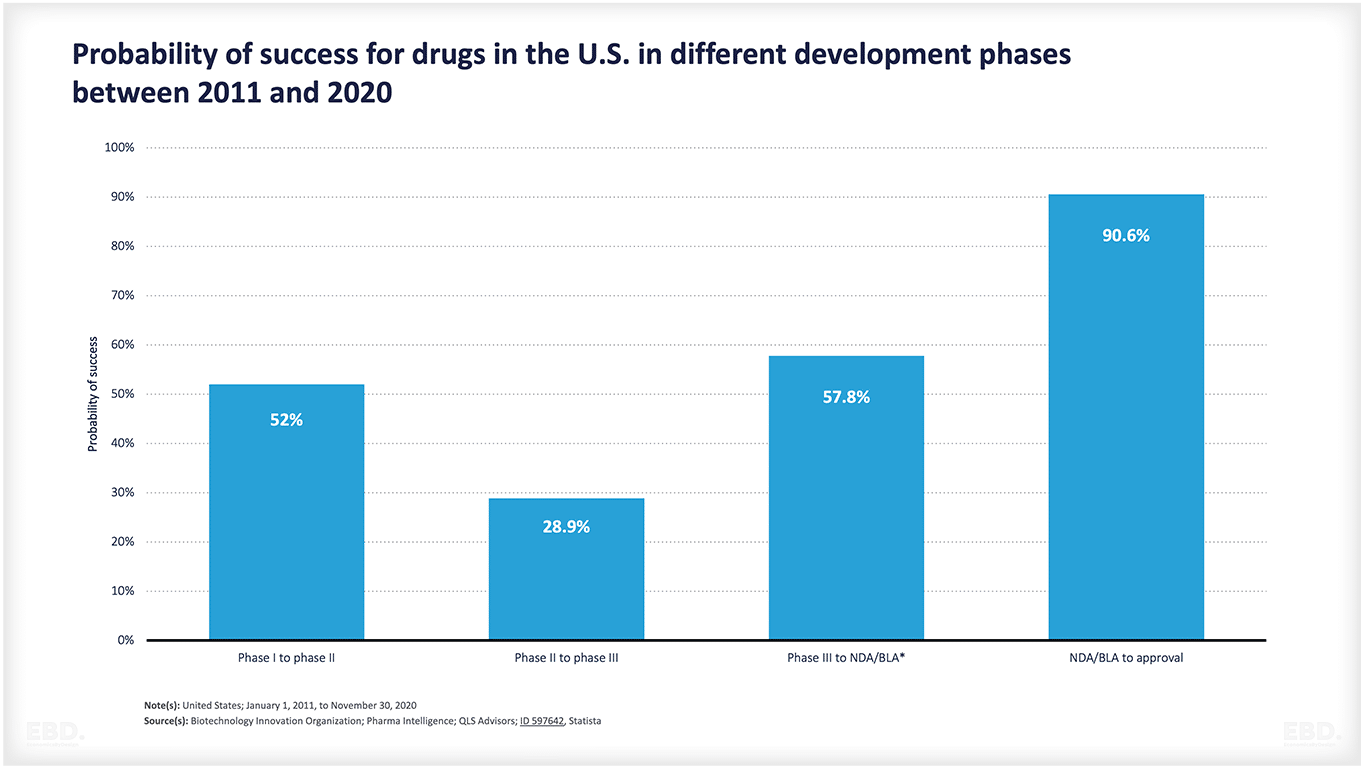
Comme l'indique le tableau ci-dessous, de nombreux produits ne passent pas du stade de la conception à celui de l'approbation. L'incertitude scientifique ou technologique est importante. Ce graphique montre que pour les médicaments aux États-Unis, environ la moitié passe du stade 1 au stade 2 et environ 29 % d'entre eux passent du stade 2 au stade 3. Plus de la moitié d'entre eux passent ensuite au stade de l'accès au marché et, s'ils y parviennent, plus de 90 % sont approuvés. Au total, seuls 7,8 % des médicaments passent de la phase préclinique à l'autorisation de mise sur le marché. Cela représente une énorme quantité de ressources consacrées à des produits qui n'atteignent pas le stade du lancement commercial.
Lancement, commercialisation, gestion du cycle de vie
Cette phase couvre toutes les activités de recherche et de développement relatives à un produit ou à un service de santé une fois qu'il a été adopté pour être déployé au sein d'une population. Les activités comprennent le contrôle de la sécurité et des effets secondaires, le contrôle de l'impact et la collecte d'éléments concrets pour éclairer les décisions concernant l'élargissement de la couverture du produit ou les types de problèmes de santé qu'il peut aider à résoudre.
Qu'est-ce que les données et les preuves du monde réel ?
Les acteurs de la recherche et du développement dans les systèmes de santé se tournent de plus en plus vers l'utilisation de données et d'éléments concrets pour éclairer leurs décisions. Les données du monde réel sont des données collectées régulièrement au sein du système de santé et au-delà. Les données factuelles sont basées sur l'analyse de données réelles.
Les utilisations potentielles des données et des preuves du monde réel sont les suivantes :
Développement clinique
- Donner la priorité au développement clinique précoce
- Étudier la maladie et son fardeau
- Étudier la gestion de la maladie
- Conception d'un essai clinique
- Exécution de l'essai Augmenter l'efficacité du recrutement des patients
Approbation réglementaire + accès au marché
- Faciliter le processus réglementaire
- Faciliter la fixation des prix, le remboursement et l'accès au marché
Commercialisation
- Fournir de nouvelles connaissances scientifiques et cliniques
- Fournir des informations commerciales et des informations sur les entreprises
- Soutenir les programmes commerciaux
- Faciliter la pharmacovigilance et la surveillance après la mise sur le marché
- Optimisation de la gestion des patients
- Expansion de l'indication
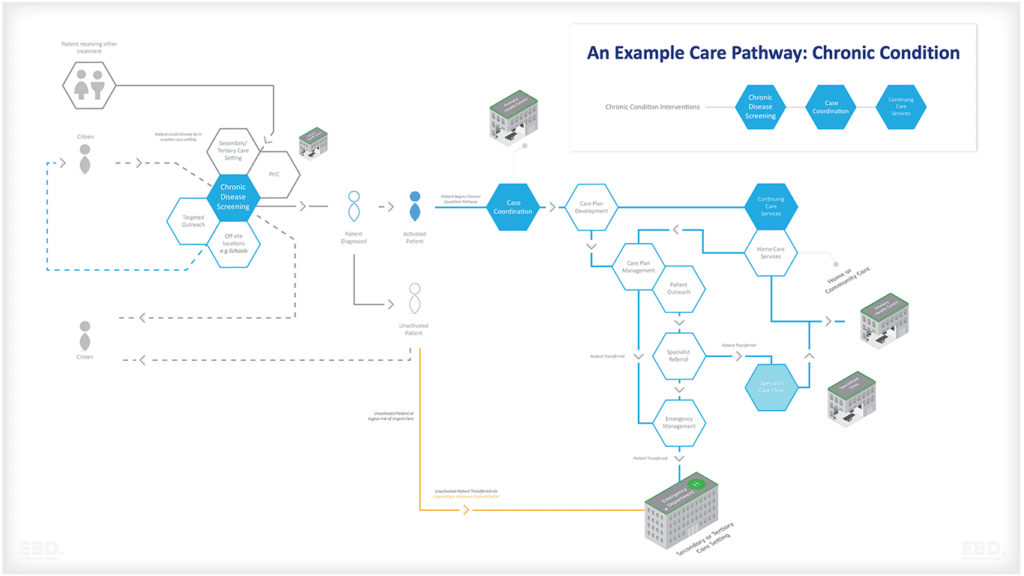
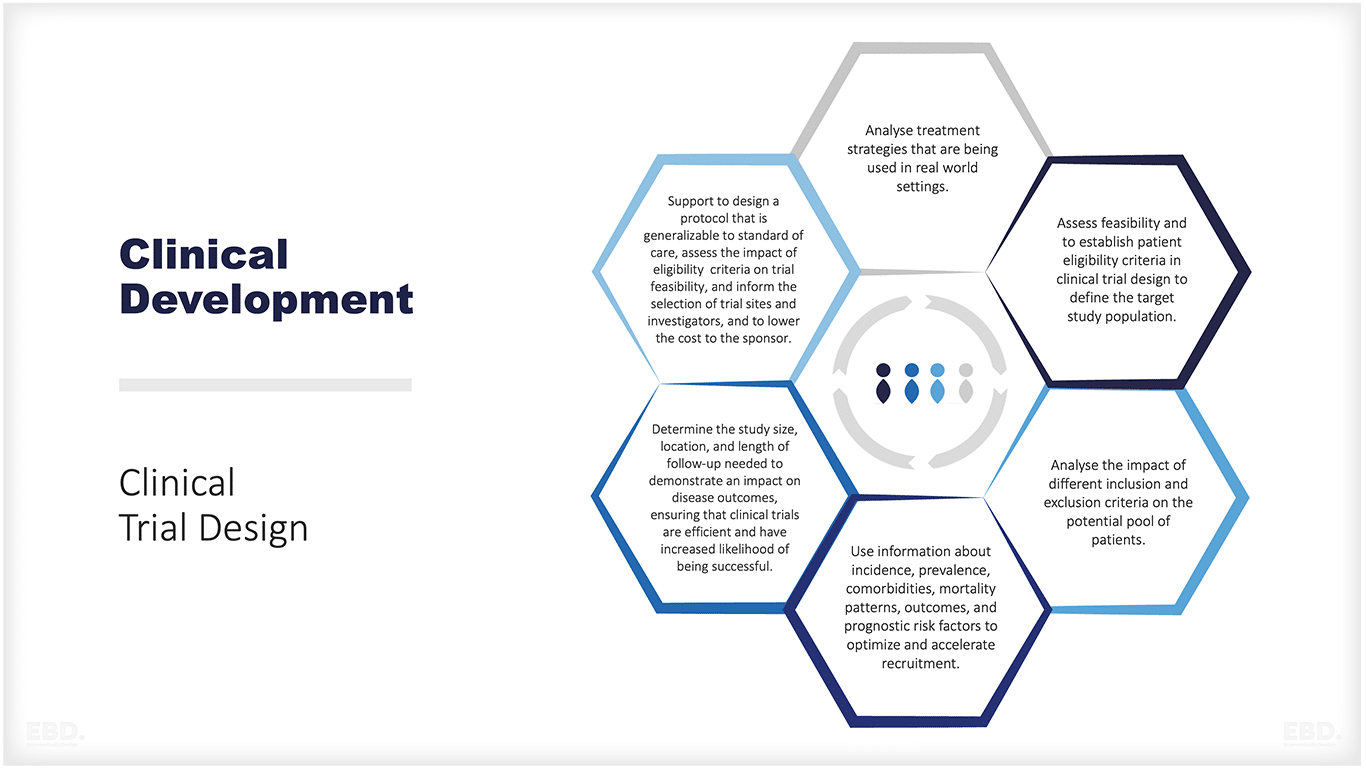
La figure ci-dessous résume les types de questions pour lesquelles les données du monde réel peuvent contribuer à la conception et à la mise en œuvre d'un essai clinique efficace.
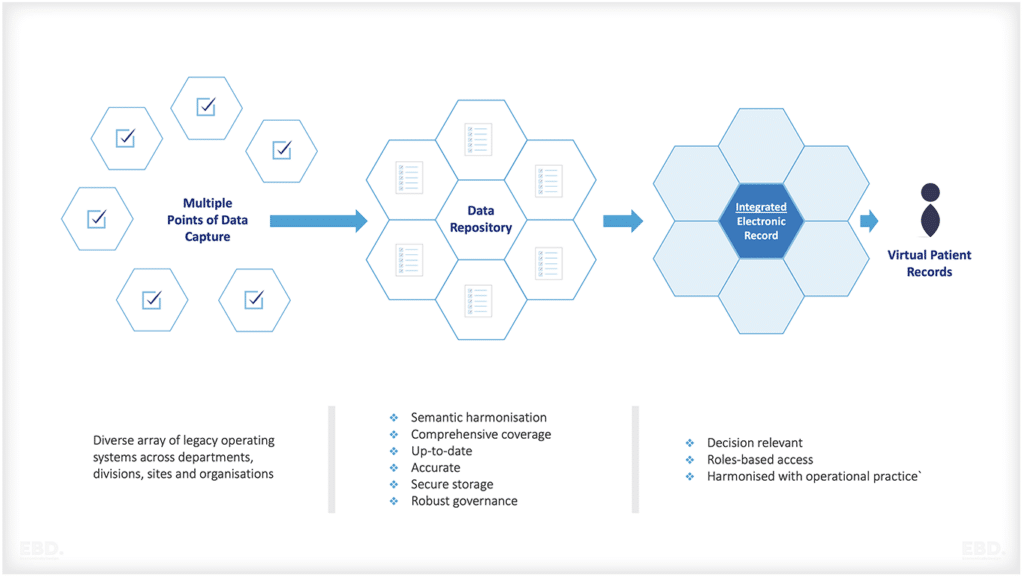
Caractéristiques d'une source de données idéale pour générer des preuves dans le monde réel
- Population de patients représentative des personnes souffrant d'une affection sous-jacente (par exemple, données démographiques, comorbidités cliniques)
- Planification prospective
- Mise à jour permanente avec un minimum de ressources
- Suivi longitudinal
- Date clinique riche : saisie par le clinicien, rapportée par le patient et générée par le patient
- Mesures de contrôle de la qualité en place
- Intégration dans les systèmes de données existants
Les données du monde réel posent des problèmes. Ces données peuvent être de qualité variable en termes de précision, elles peuvent également être partielles en termes de couverture. Les données du monde réel ne sont pas nécessairement régulières ou opportunes, et peuvent ne pas fournir des informations complètes dans tous les domaines d'intérêt. Toutefois, à mesure que les capacités numériques des systèmes de santé se développent, ces problèmes deviennent moins un obstacle à l'utilisation de données réelles par la communauté de la recherche et du développement.
Qu'est-ce que la gouvernance de la recherche ?
La recherche et le développement dans le domaine des soins de santé posent de nombreuses questions éthiques. Les participants à la recherche sont invités à devenir des bancs d'essai humains pour de nouveaux produits et services qui pourraient ne pas fonctionner ou, pire, être nocifs. On leur demande souvent de participer parce qu'ils vivent déjà avec une affection ou une maladie. Ils sont également invités à fournir des données et des informations très personnelles à une équipe de recherche.
La gouvernance de la recherche est définie comme l'ensemble des règlements, règles, principes et normes qui garantissent une recherche de haute qualité. Une gouvernance de la recherche bien conçue doit garantir à toutes les parties prenantes que la recherche est effectuée selon les normes de qualité requises, qu'elle a un but et une valeur, et que les normes de participation, de protection des participants et des chercheurs, et de partage de l'information sont respectées.
Elle devrait également permettre le suivi des performances et le partage des bonnes pratiques en matière de soins de santé. La gouvernance de la recherche couvre toutes les recherches liées à la santé qui impliquent des personnes, leurs tissus ou leurs données.
Les dispositions relatives à la gouvernance de la recherche varient d'un pays à l'autre. Dans certains pays, des dispositions strictes sont en place et l'approbation est requise pour toutes les recherches impliquant des personnes, leurs tissus ou leurs données. L'approbation éthique est subordonnée à la qualité du protocole de recherche et à la mise en place d'un système de consentement pour les participants.
Dans certains pays, ces dispositions n'ont pas encore été prises. Lorsque la recherche est entreprise dans des pays où la gouvernance de la recherche n'est pas en place et/ou où l'approbation éthique n'a pas été donnée, il peut être difficile pour les chercheurs de voir leur recherche publiée dans des revues à comité de lecture.
Voici quelques exemples utiles de dispositifs et d'organisations de gouvernance de la recherche :
- Le règlement européen sur les essais cliniques, qui régit les essais cliniques au sein de la Commission européenne.
- L'autorité de recherche en santé du NHS fournit un cadre politique pour les bonnes pratiques en matière de gestion et de conduite de la recherche dans le domaine de la santé et des soins sociaux au Royaume-Uni.
- Le site web ClinRegs du National Institute of Allergy and Infectious Diseases (NIAD) des États-Unis fournit des informations spécifiques sur les réglementations en matière de recherche clinique dans certains pays du monde.
Quel est le niveau d'investissement dans la recherche et le développement en matière de santé ?
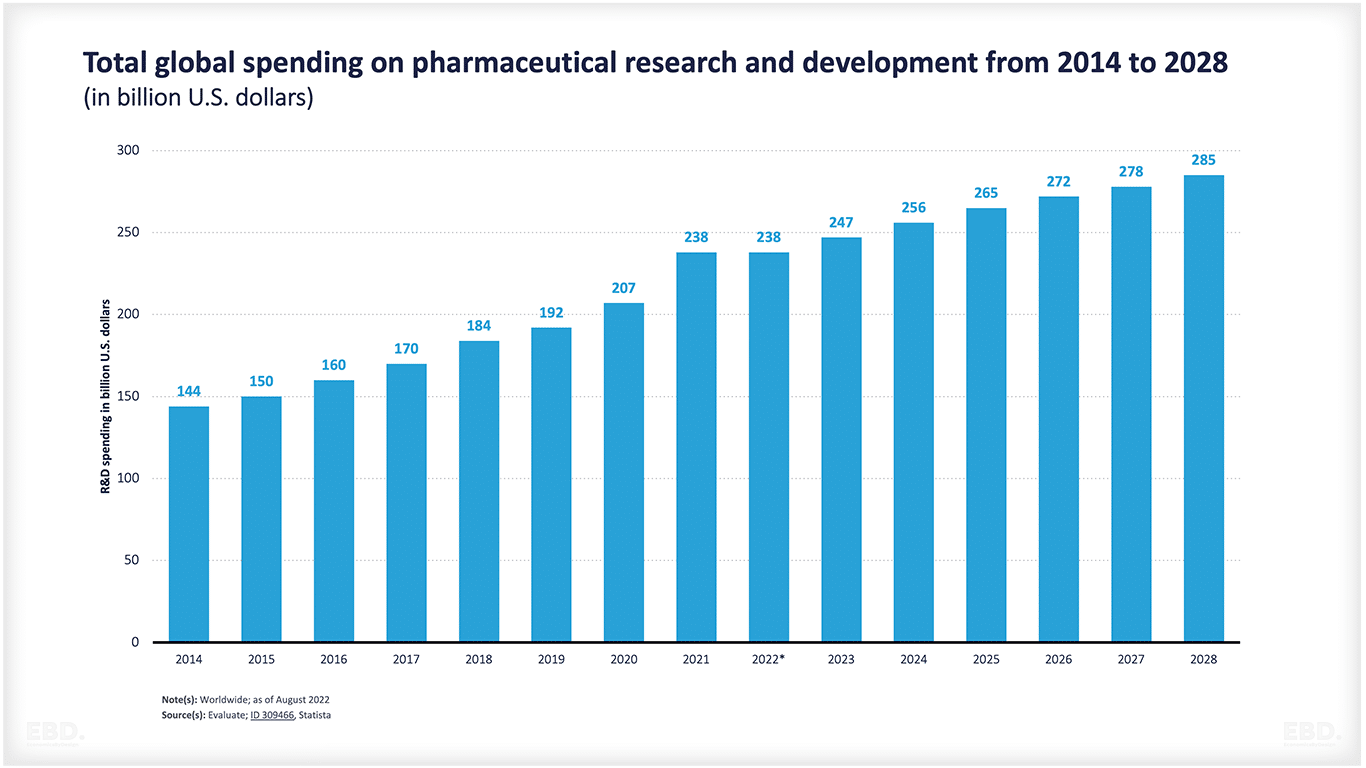
Selon l'Institut de statistique de l'UNESCO , le monde a dépensé l'équivalent de 2,47 milliards de dollars en recherche et développement en 2022. Sur ce montant, 238 milliards de dollars sont consacrés à la recherche et au développement pharmaceutiques et ce chiffre devrait atteindre 285 milliards de dollars d'ici à 2028.
De nombreuses parties prenantes participent au financement de la recherche et du développement, notamment des entreprises privées (par exemple, des sociétés pharmaceutiques, des sociétés de dispositifs médicaux, des sociétés de santé numérique), le gouvernement par l'octroi de subventions et de prix, et par l'hébergement de la recherche dans des fournisseurs de services de santé gérés par le gouvernement, ainsi que des organismes de bienfaisance dans le domaine de la recherche médicale.
Voici quelques exemples de grandes entreprises pharmaceutiques mondiales qui investissent dans la recherche et le développement :
Les principaux bailleurs de fonds philanthropiques de la recherche en santé dans le monde sont les suivants :
- Wellcome Trust
- Institut médical Howard Hughes
- Fondation Bill et Melinda Gates
- Institut Pasteur
- Fondation Oswaldo Cruz
- Fondation Rockefeller
Qui assure la recherche et le développement dans le domaine de la santé ?
La plupart des activités de recherche et de développement dans le domaine de la santé sont menées par des universitaires cliniciens, des cliniciens financés par des organismes de financement de la recherche et des prestataires de soins de santé universitaires qui accueillent la recherche.
Les centres universitaires de sciences de la santé sont des prestataires de soins de santé qui combinent la recherche, l'enseignement et la prestation de services. En voici quelques exemples :
- Johns Hopkins (École de santé publique, École d'infirmières, École de médecine) aux États-Unis
- Partenaires de l'UCL enAngleterre
- Hôpital cérébral de Npistanbulen Turquie
- Centre médical de l'Université de Leiden aux Pays-Bas
Quelle est la valeur de la recherche et du développement en matière de santé financés par les pouvoirs publics ?
Les gouvernements financent la recherche et le développement dans le domaine de la santé afin de stimuler les investissements des secteurs philanthropique et commercial, et de permettre l'accès aux fonds dans des domaines où les incitations commerciales sont relativement faibles.
La recherche et le développement en matière de santé financés par les pouvoirs publics peuvent donc apporter une valeur ajoutée, à la fois en stimulant la croissance économique et en favorisant l'amélioration de la santé de la population et des individus.
Il existe très peu d'études montrant le retour sur investissement du financement public de la recherche et du développement, mais certaines études ont montré des retours positifs pour des études de cas sélectionnées.
- Grant J, Buxton MJ Les rendements économiques du financement de la recherche médicale BMJ Open 2018;8:e022131. doi : 10.1136/bmjopen-2018-022131 ont montré des rendements de 7 % à 10 % en termes de gain de santé, et 15 % supplémentaires provenant de l'impact économique plus large. Ces résultats sont basés sur les investissements dans la recherche cardiovasculaire, cancéreuse et musculo-squelettique au Royaume-Uni.
- Joyce Craig et ses collègues de l'université de York ont estimé à environ 29 % le retour sur investissement du financement des centres de recherche biomédicale au Royaume-Uni.
- Une étude récente menée par un consortium composé du Kings College de Londres, de RAND Europe et de l'université de Brunel a suggéré un retour sur investissement d'environ 25 % (sur la base de la recherche sur les maladies musculo-squelettiques au Royaume-Uni).
Le facteur le plus important à prendre en compte lorsqu'on examine la valeur d'investissement de la recherche et du développement dans le domaine des soins de santé est qu'elle est intrinsèquement incertaine. C'est pourquoi les systèmes de santé doivent être prêts à prendre des risques et/ou à soutenir les entreprises qui sont prêtes à prendre des risques.
Observatoire mondial de la R&D en santé
L'Observatoire mondial de la R&D en santé de l'Organisation mondiale de la santé est l'une des meilleures sources d'information sur la recherche et le développement dans le domaine de la santé au niveau mondial. Il fournit des informations et des analyses basées sur une synthèse de données et d'informations provenant du monde entier sur la recherche et le développement des maladies.
Il s'agit d'une ressource vraiment riche pour tous ceux qui veulent savoir ce qui fait l'objet de recherches et où se situent les lacunes. Il s'agit d'un guichet unique pour les chercheurs dans ce domaine.