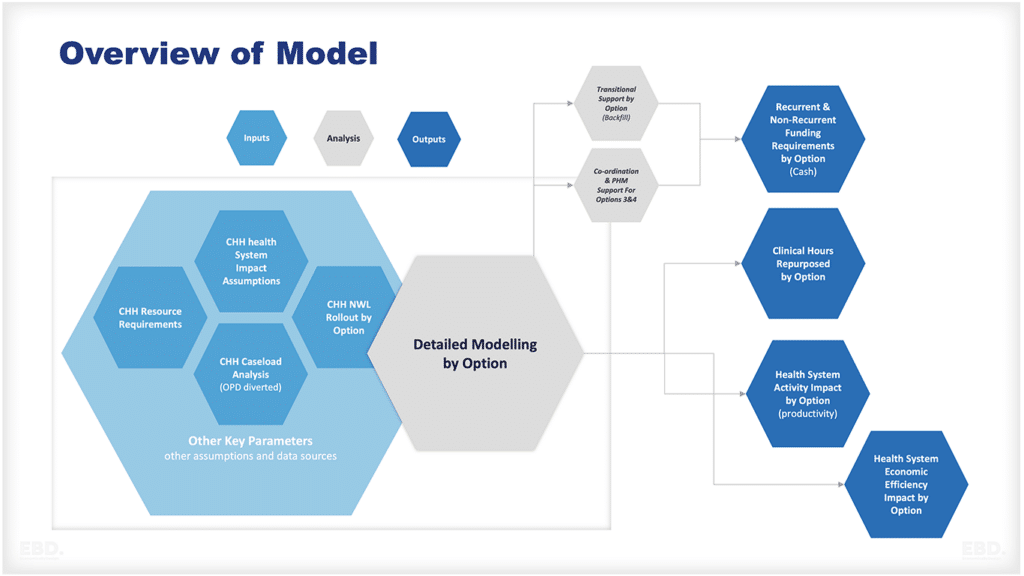
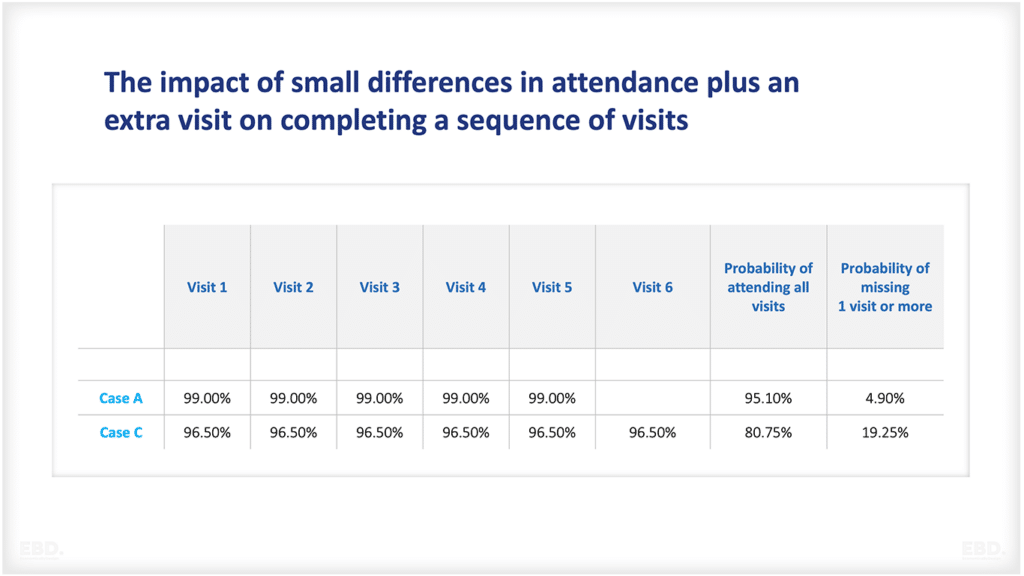
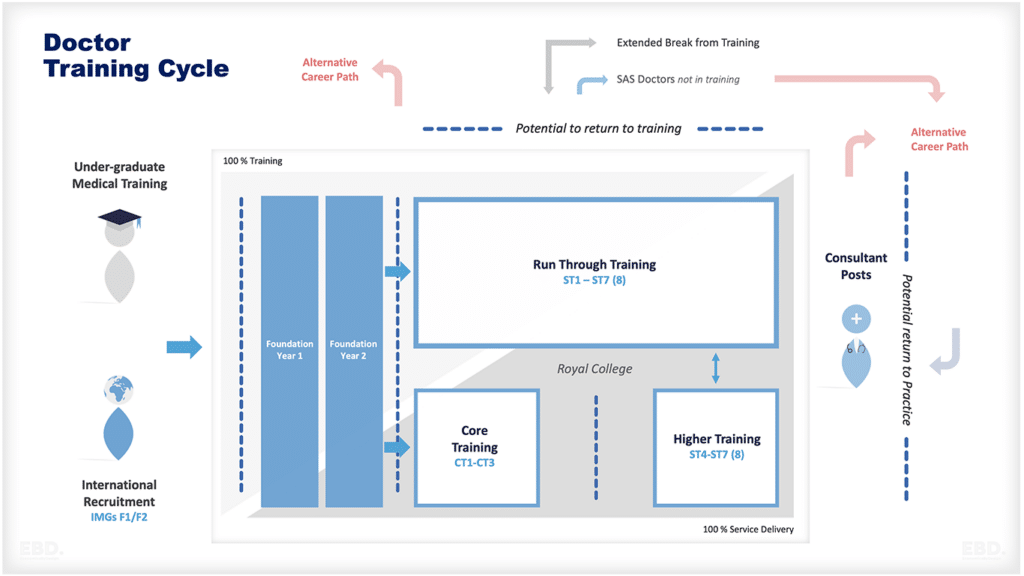
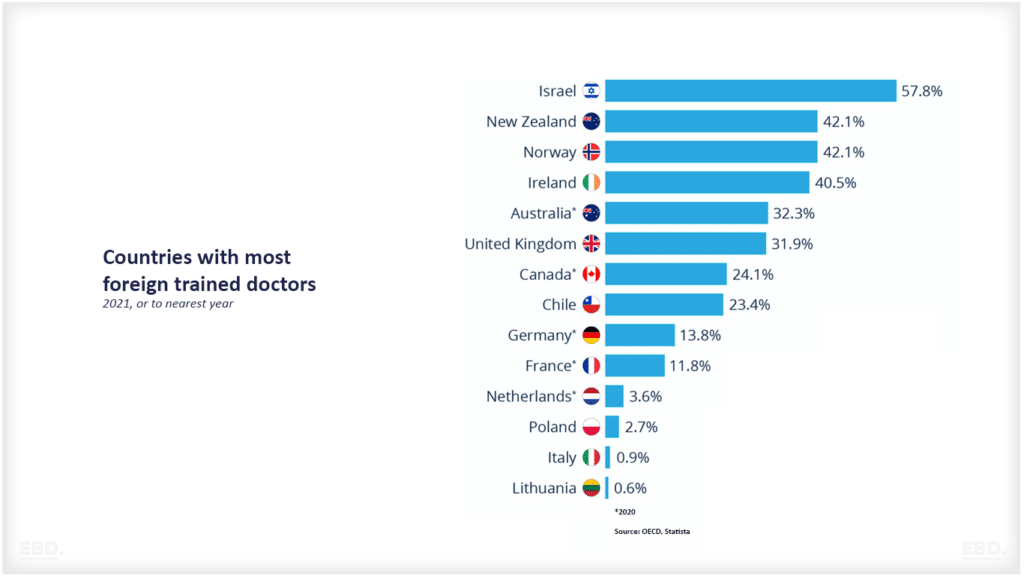
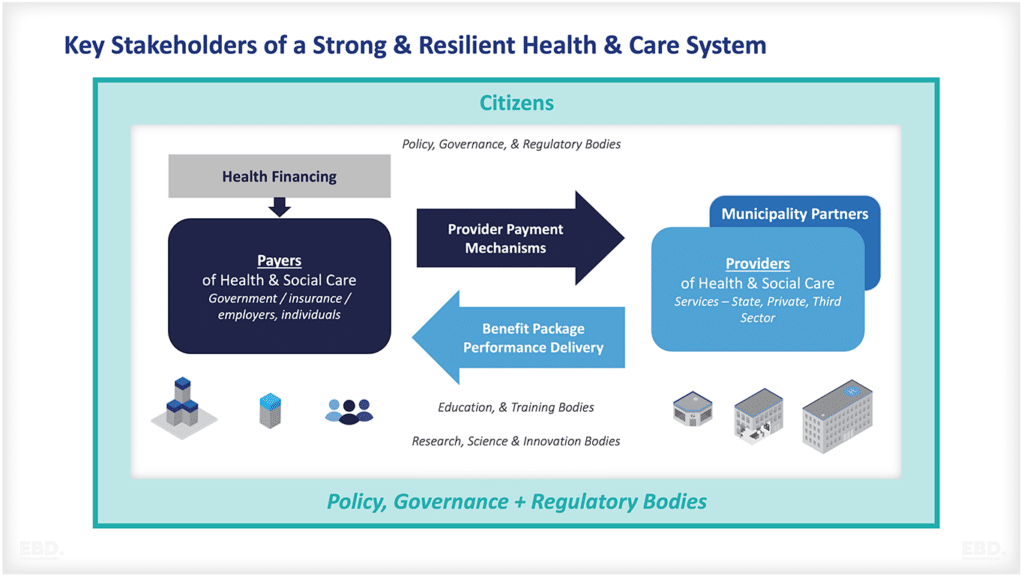
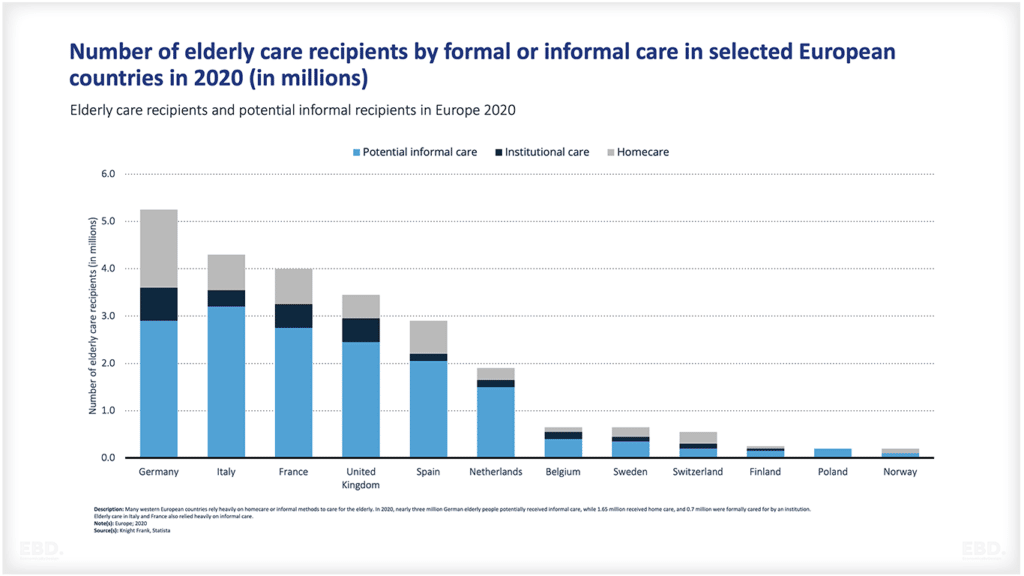
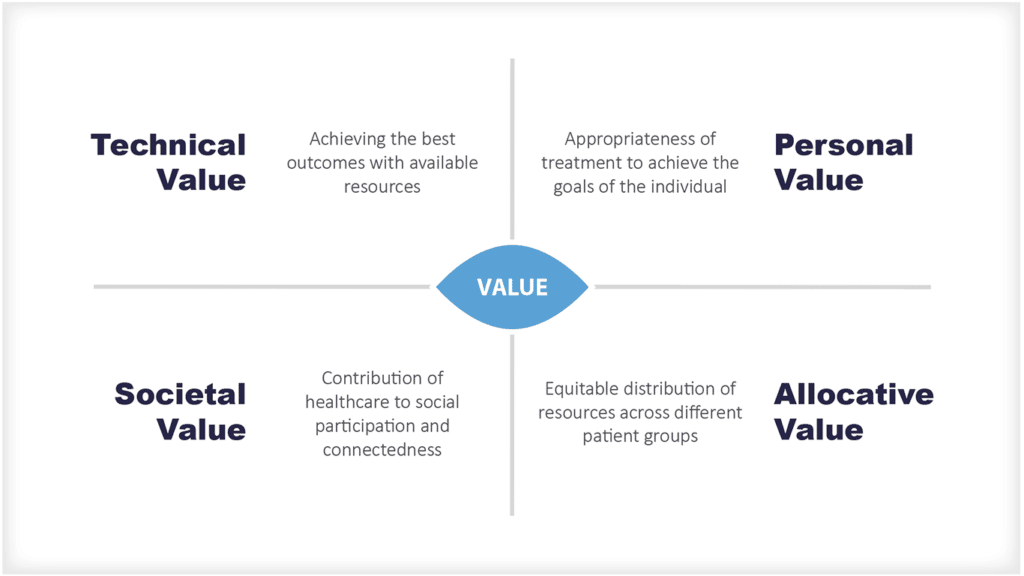
Warum gibt es Forschung und Entwicklung im Gesundheitswesen?
Gesundheitsforschung und -entwicklung sind für den Gesundheitssektor von großer Bedeutung. Sie liefert klinisch tätigen Ärzten und Investoren im Gesundheitswesen Innovationen und damit verbundene Erkenntnisse für Präventionsmaßnahmen, wirksame Behandlungen und Versorgungspfade.
In dieser wirtschaftlichen Betrachtung geben wir einen Überblick über Forschung und Entwicklung im Gesundheitswesen und ihre Rolle im Gesundheitssystem.
Was ist Gesundheitsforschung und -entwicklung?
Bei der Forschung und Entwicklung geht es im Wesentlichen darum, einen Bedarf oder ein Problem zu ermitteln, eine Idee oder eine Lösung zu finden, diese Idee in ein Produkt oder eine Dienstleistung umzusetzen, das Produkt oder die Dienstleistung auf Wirksamkeit, Effektivität und Wert zu testen, das Produkt oder die Dienstleistung auf den Markt zu bringen, das Produkt oder die Dienstleistung weiterhin zu überwachen, zu bewerten und zu verbessern und schließlich das Produkt oder die Dienstleistung außer Betrieb zu nehmen, wenn es veraltet ist.
Zu den Produkten gehören in der Regel Medizinprodukte, Arzneimittel und Impfstoffe, Gentherapielösungen und Diagnoseinstrumente. Sie können auch Dienstleistungen und Versorgungspfade umfassen, einschließlich Prävention, Behandlung und Pflege sowie Rehabilitation.
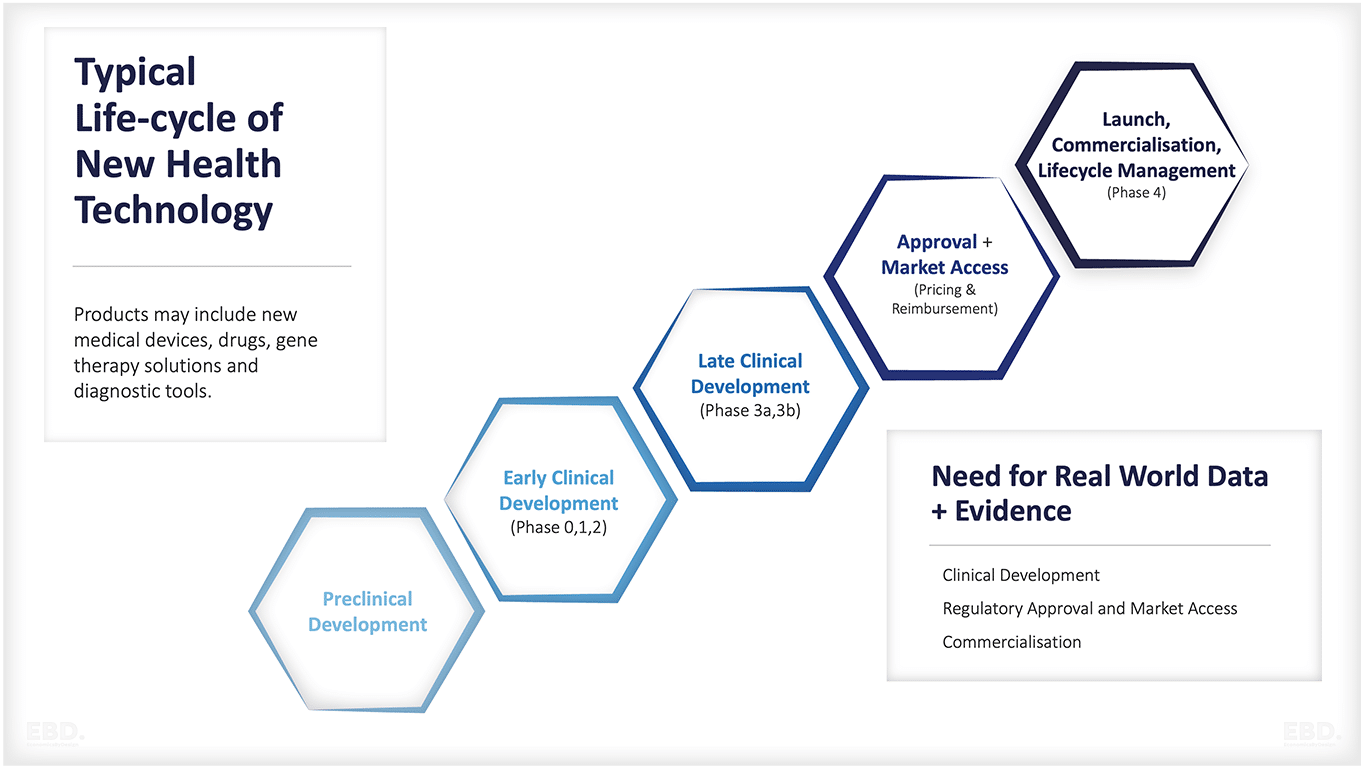
Die wichtigsten Phasen der Gesundheitsforschung und -entwicklung sind:
Präklinische Entwicklung
Dies umfasst alle Aktivitäten, die stattfinden, bevor ein Produkt oder eine Dienstleistung an Menschen getestet wird. Bei klinischen Maßnahmen wie Arzneimitteln, Medizinprodukten, Gentherapie, Diagnoseinstrumenten usw. umfasst dies Durchführbarkeits- und Sicherheitsprüfungen usw., die häufig in Labors durchgeführt werden.
Ein Teil der präklinischen Entwicklung wird an Tieren durchgeführt. In-vitro-Tests werden "außerhalb des Körpers" oder "außerhalb des normalen biologischen Kontextes" durchgeführt, beispielsweise in einem Reagenzglas oder einer Petrischale. In vivo bedeutet, dass die Tests "am lebenden Objekt" durchgeführt werden, und im Falle der vorklinischen Entwicklung handelt es sich um Tierversuche.
Die präklinische Entwicklung umfasst häufig so genannte "Beobachtungsstudien". Dabei wird der Gesundheitszustand einer Bevölkerung oder Bevölkerungsgruppe beobachtet, um festzustellen, wo Probleme bestehen und wo Präventions- und Behandlungsmaßnahmen greifen könnten.
Frühe klinische Entwicklung
Dies ist der Zeitpunkt, an dem die Tests an Menschen durchgeführt werden. In diesen frühen Stadien wird das Medikament oder Gerät in der Regel auf Sicherheit oder Dosierung getestet und um zu sehen, wie sich die klinische Intervention auf den Menschen auswirkt. In dieser Phase werden häufig klinische Prüfungen der Stufen 0, 1 und 2 durchgeführt, d. h. Forschungsstudien, in denen die Auswirkungen eines Produkts oder einer Dienstleistung auf Menschen getestet werden. Das Stadium der Studie spiegelt im Allgemeinen die Anzahl der Teilnehmer wider, die sich erhöht, je mehr man über Dosierung, Sicherheit und Nebenwirkungen erfährt.
Späte klinische Entwicklung
Dies ist die Phase, in der das Produkt oder die Dienstleistung in großem Maßstab an einer Bevölkerungsgruppe getestet wird. Diese Versuche der Stufe 3 sind komplex, zeitaufwändig und oft teuer. Ziel der Studie ist es, die Auswirkungen des Produkts oder der Dienstleistung auf die Gesundheitsergebnisse zu testen.
Es ist wichtig, die Auswirkungen des Produkts oder der Dienstleistung von anderen Faktoren zu isolieren, die unabhängig voneinander Veränderungen bei den Gesundheitsergebnissen erklären. Aus diesen Gründen werden klinische Studien der Stufe 3 häufig als randomisierte kontrollierte Studien (RCTs) konzipiert.
Bei einer RCT werden die Studienteilnehmer nach dem Zufallsprinzip in verschiedene Gruppen eingeteilt: diejenigen, die die Intervention erhalten (Behandlungsgruppe) und diejenigen, die sie nicht erhalten (Kontrollgruppe). Häufig geschieht dies "blind", d. h. die Teilnehmer wissen nicht, ob sie die Maßnahme erhalten oder nicht. Im Falle eines Medikaments können sie z. B. ein "Placebo" (eine Behandlung ohne therapeutischen Wert) erhalten.
In manchen Fällen kann die Phase-3-Studie "doppelblind" sein, d. h. der Arzt, der die Intervention durchführt, weiß nicht, welcher Teilnehmer die Behandlung oder das Placebo erhält.
Wenn die Studienpopulation repräsentativ für die Allgemeinbevölkerung oder die Zielpopulation für die Behandlung ist, kann das RCT-Verfahren sicherstellen, dass alle Faktoren, die das gesundheitliche Ergebnis beeinflussen könnten (wie Alter, andere Gesundheitszustände, Fitness usw.), mit gleicher Wahrscheinlichkeit die Behandlungs- und die Kontrollgruppe beeinträchtigen und daher ignoriert werden können. Der einzige Grund für ein unterschiedliches gesundheitliches Ergebnis zwischen der Behandlungsgruppe und der Kontrollgruppe ist der therapeutische Wert des Produkts oder der Dienstleistung.
In der Praxis ist es sehr schwierig und/oder kostspielig, RCTs zu konzipieren, und daher werden in Phase-3-Studien häufig andere Techniken eingesetzt, um das Risiko der so genannten "Attributionsverzerrung" zu minimieren, d. h. dass beobachtete Unterschiede bei den Ergebnissen der Behandlungsgruppe fälschlicherweise dem Produkt oder der Dienstleistung zugeschrieben werden.
Wenn für das Produkt oder die Dienstleistung eine behördliche Zulassung erforderlich ist, werden die klinischen Prüfungen der Stufe 3 in der Regel durchgeführt, nachdem ein Antrag auf behördliche Zulassung gestellt wurde, aber bevor diese erteilt wird.
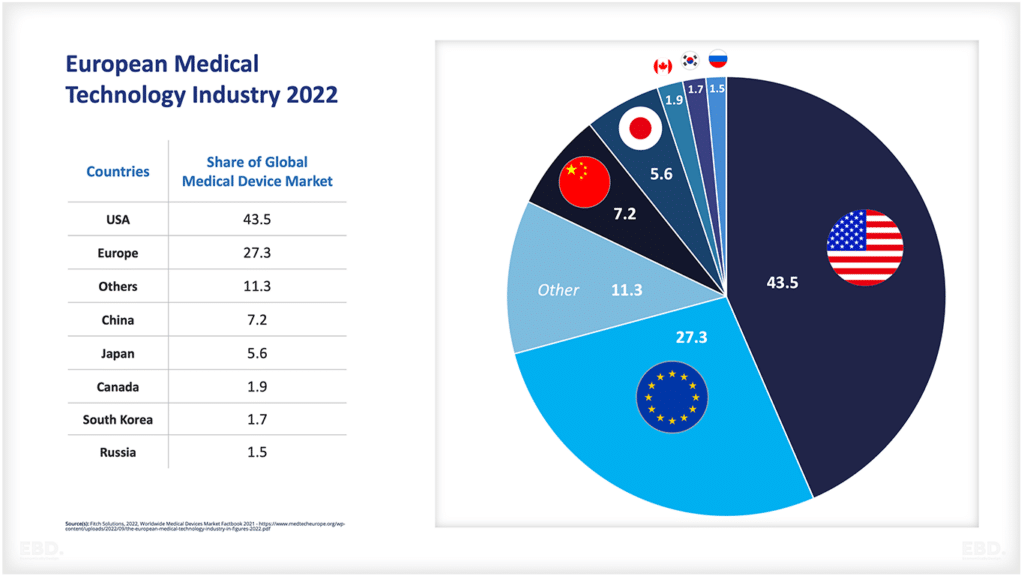
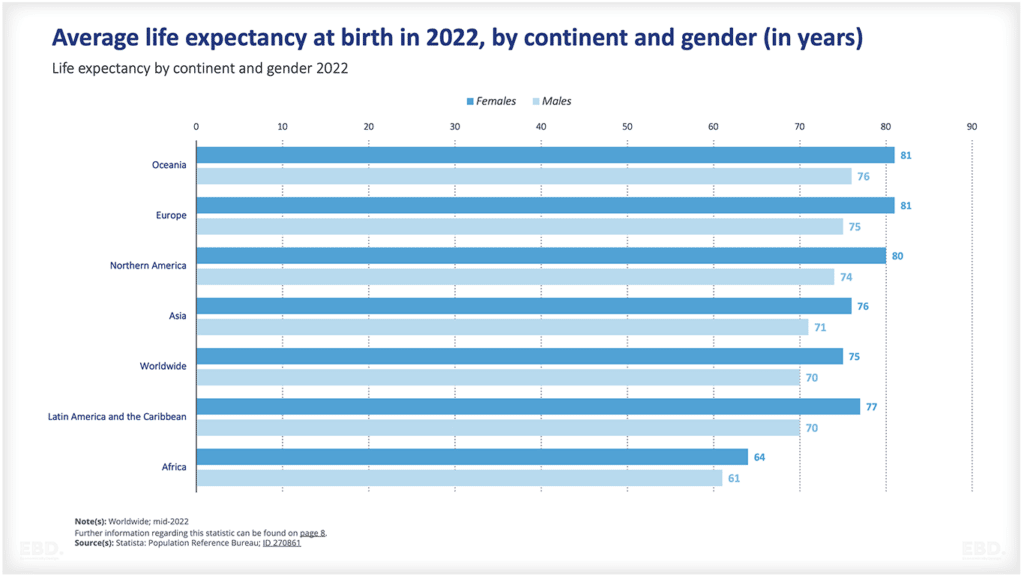
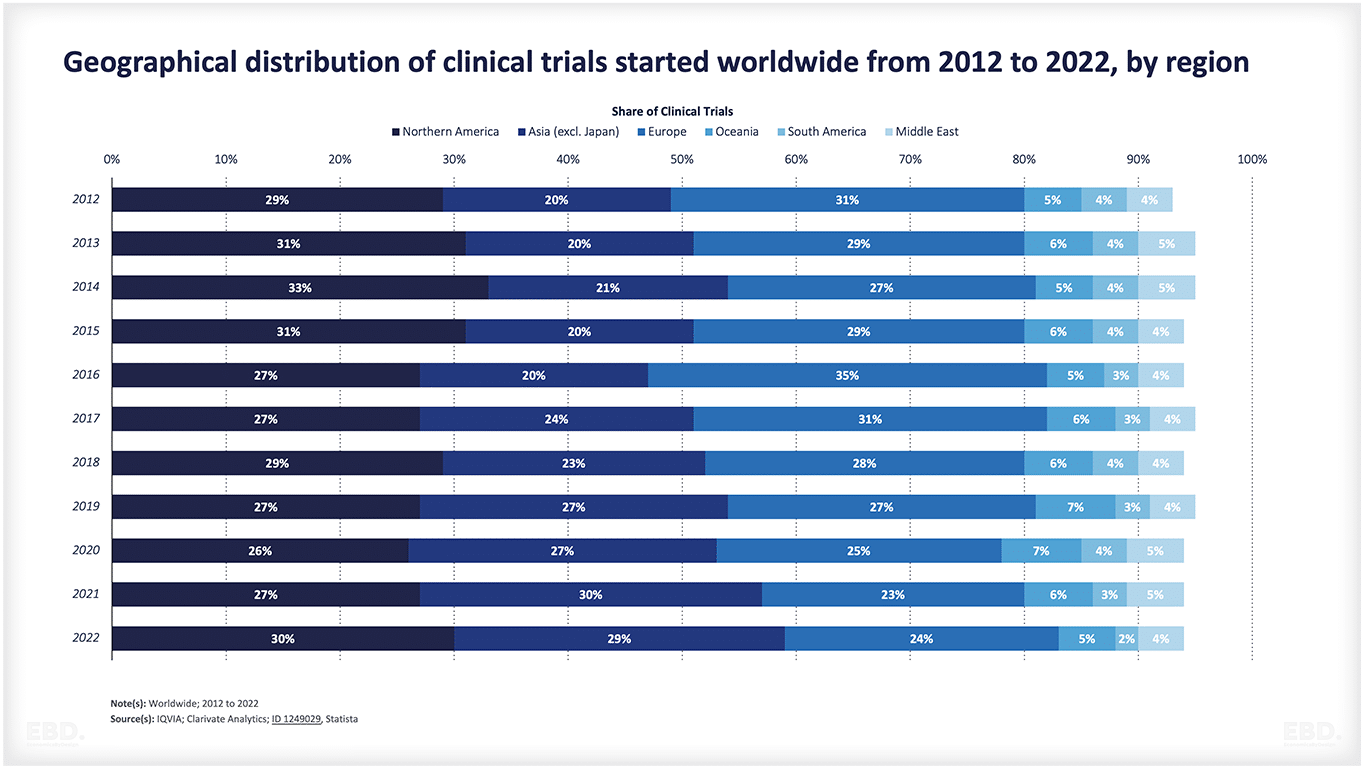
Aus dem nachstehenden Schaubild geht hervor, dass die überwiegende Mehrheit der klinischen Prüfungen derzeit in Nordamerika, Asien und Europa durchgeführt wird.
Marktzulassung, Preisgestaltung und Kostenerstattung
In dieser Phase wird das Produkt oder die Dienstleistung von der zuständigen Aufsichtsbehörde genehmigt (falls erforderlich), und es werden Entscheidungen über die Preisgestaltung und Kostenerstattung mit denjenigen getroffen, die für die Bezahlung oder Beauftragung der Gesundheitsversorgung im Namen der Bevölkerung verantwortlich sind.
In dieser Phase müssen häufig zusätzliche Informationen gesammelt werden, insbesondere wirtschaftliche Daten, um den Wert des Produkts oder der Dienstleistung nachzuweisen. Dies wird oft als Health Technology Appraisal (HTA) bezeichnet. Die Organisation, die das Produkt oder die Dienstleistung entwickelt hat, wird aufgefordert, Daten zur Unterstützung dieses Prozesses vorzulegen, und der Kostenträger beauftragt unabhängige Sachverständige mit der Durchführung des HTA.
Für einige Kostenträger gibt es klare Benchmarks oder Leitlinien in Bezug auf Wirksamkeit und Wert, die erreicht werden müssen, damit das Produkt oder die Dienstleistung in das Paket der Gesundheitsleistungen aufgenommen werden kann. Bei anderen werden die Entscheidungen von Fall zu Fall getroffen. Häufig werden Entscheidungen über die Aufnahme von Produkten oder Dienstleistungen in die wesentlichen Gesundheitsleistungen auf Anraten eines Fachausschusses getroffen, der sich aus Experten auf dem Gebiet sowie aus Patientenvertretern zusammensetzt.
In zunehmendem Maße knüpfen Kostenträger und Regulierungsbehörden die Zulassung, Preisgestaltung und Kostenerstattung an die Bedingung, dass das Produkt oder die Dienstleistung einigen zusätzlichen Datenerhebungs- und Überwachungsanforderungen unterzogen wird, um die Wirksamkeit und den Wert sicherzustellen.
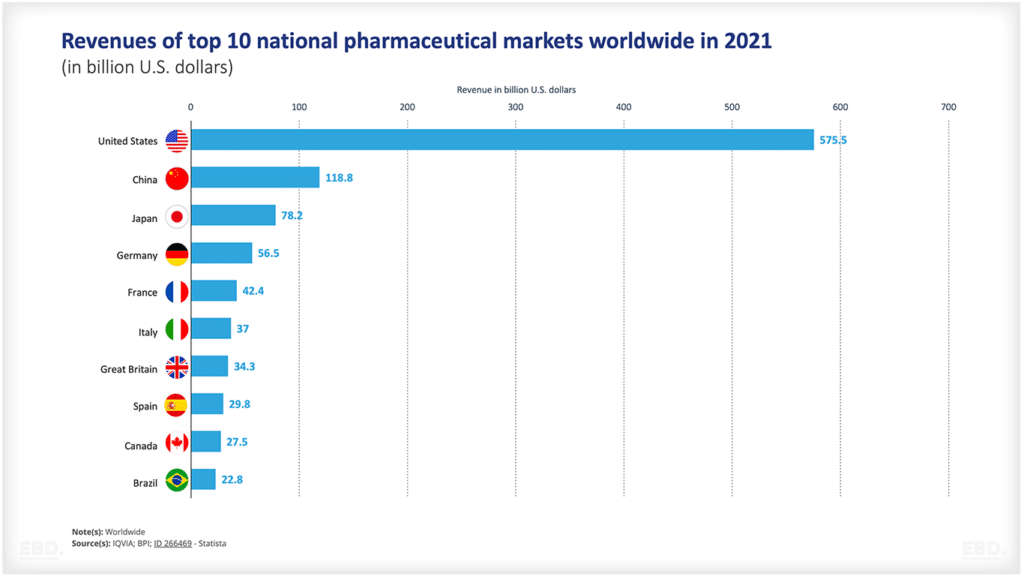
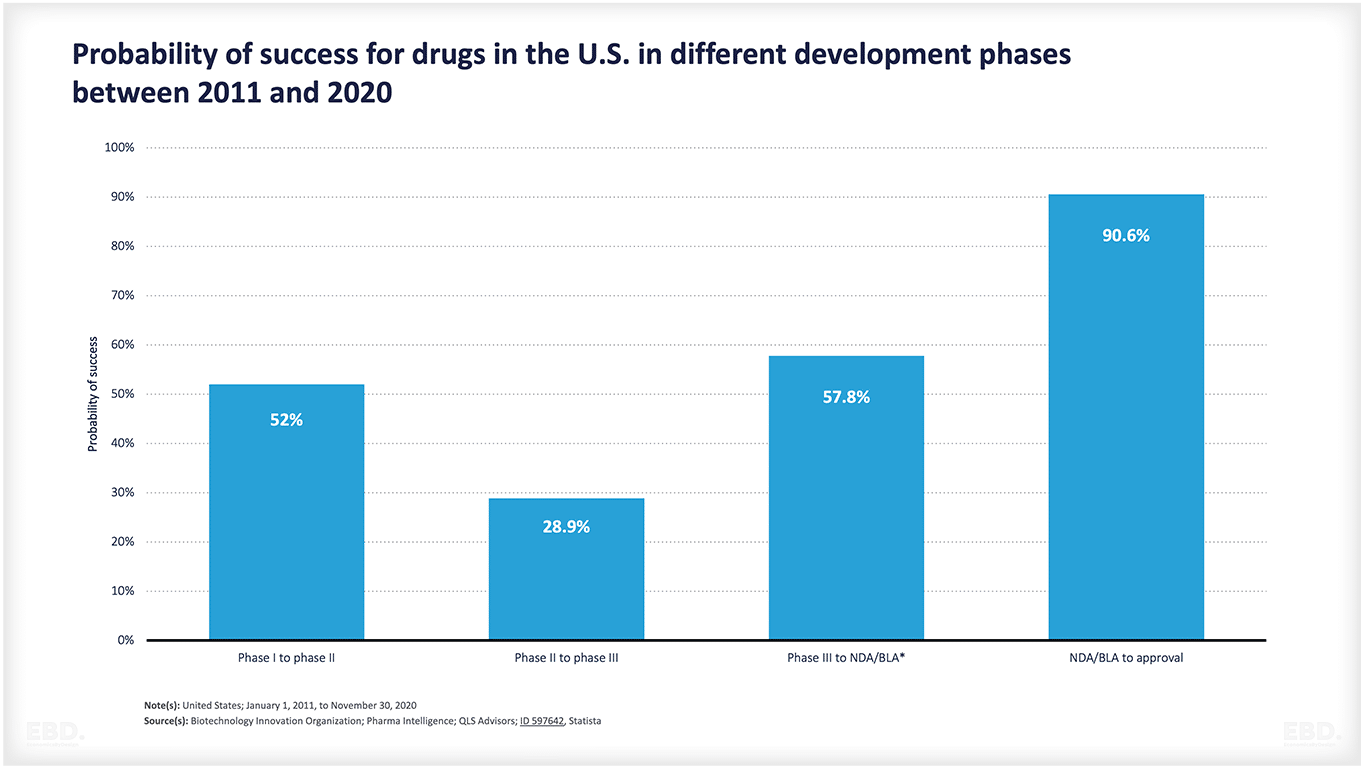
Wie die nachstehende Tabelle zeigt, schaffen es viele Produkte nicht von der Konzeption bis zur Zulassung. Es besteht eine große wissenschaftliche oder technologische Unsicherheit. Aus dieser Grafik geht hervor, dass in den USA etwa die Hälfte der Arzneimittel von der Stufe 1 in die Stufe 2 und etwa 29 % von der Stufe 2 in die Stufe 3 übergehen. Mehr als die Hälfte erreicht dann die Marktzugangsstufe, und wenn sie diese erreichen, werden über 90 % zugelassen. Insgesamt gelangen jedoch nur 7,8 % der Arzneimittel von der vorklinischen Phase zur Zulassung. Das ist eine enorme Menge an Ressourcen, die für Produkte aufgewendet werden, die es nicht bis zur Markteinführung schaffen.
Einführung, Kommerzialisierung, Lebenszyklusmanagement
Diese Phase umfasst alle Forschungs- und Entwicklungsaktivitäten im Zusammenhang mit einem Gesundheitsprodukt oder einer Gesundheitsdienstleistung, sobald dieses/diese für den Einsatz in einer Bevölkerung angenommen wurde. Zu den Aktivitäten in dieser Phase gehören die Überwachung der Sicherheit und der Nebenwirkungen, die Beobachtung der Auswirkungen und die Sammlung von Erkenntnissen aus der Praxis, die als Grundlage für Entscheidungen darüber dienen, ob das Produkt seinen Erfassungsbereich auf die Bevölkerung ausdehnen kann oder für welche Arten von Gesundheitsstörungen es geeignet ist.
Was sind Daten und Beweise aus der realen Welt?
Die Forschungs- und Entwicklungsakteure in den Gesundheitssystemen legen zunehmend Wert auf die Verwendung von realen Daten und Erkenntnissen, um Entscheidungen zu treffen. Daten aus der realen Welt sind Daten, die routinemäßig innerhalb des Gesundheitssystems und darüber hinaus erhoben werden. Erkenntnisse aus der realen Welt beruhen auf der Analyse von Daten aus der realen Welt.
Mögliche Verwendungszwecke für Daten und Nachweise aus der Praxis sind
Klinische Entwicklung
- Vorrang für die frühe klinische Entwicklung
- Untersuchung der Krankheit und ihrer Belastung
- Untersuchung der Krankheit Management
- Klinischer Versuchsplan
- Studiendurchführung Effizienzsteigerung bei der Patientenrekrutierung
Regulatorische Zulassung + Marktzugang
- Erleichterung des Regulierungsprozesses
- Erleichterung von Preisgestaltung, Erstattung und Marktzugang
Kommerzialisierung
- neue wissenschaftliche und klinische Erkenntnisse zu liefern
- Bereitstellung von kommerziellen und geschäftlichen Einblicken
- Unterstützung kommerzieller Programme
- Erleichterung der Pharmakovigilanz und Überwachung nach der Markteinführung
- Optimierung der Patientenverwaltung
- Erweiterung der Indikation
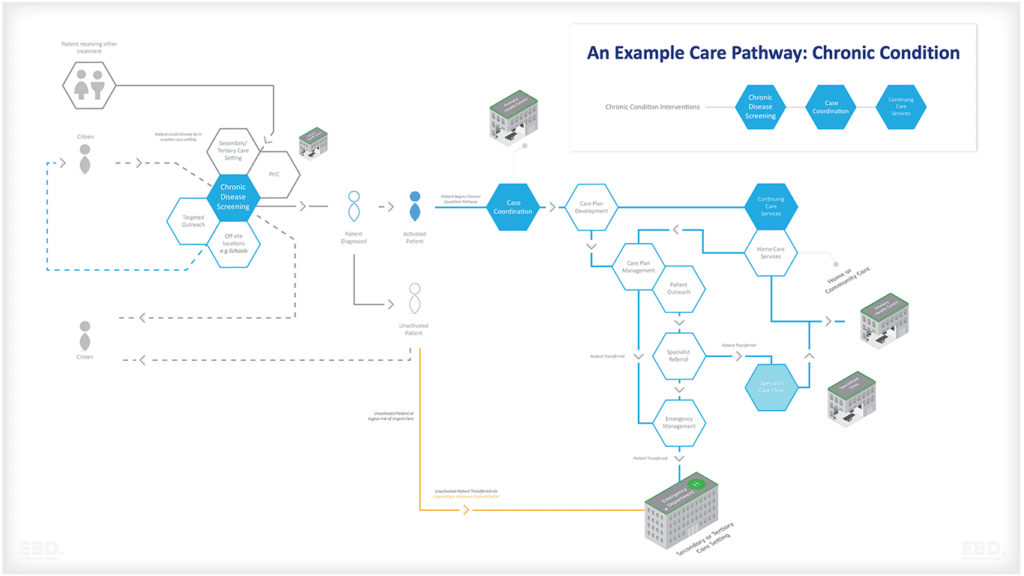
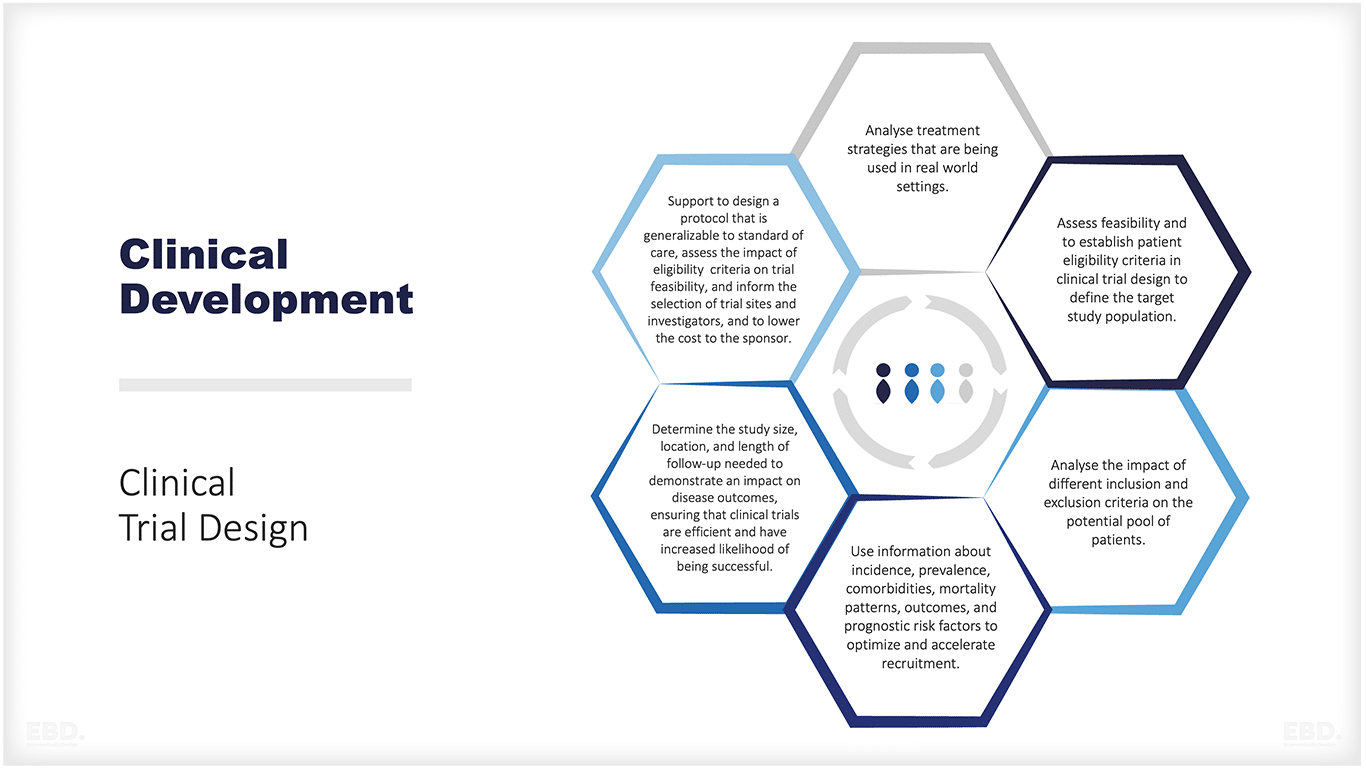
Die folgende Abbildung gibt einen Überblick über die Arten von Themen, bei denen Daten aus der Praxis die Konzeption und Durchführung einer wirksamen klinischen Prüfung unterstützen können.
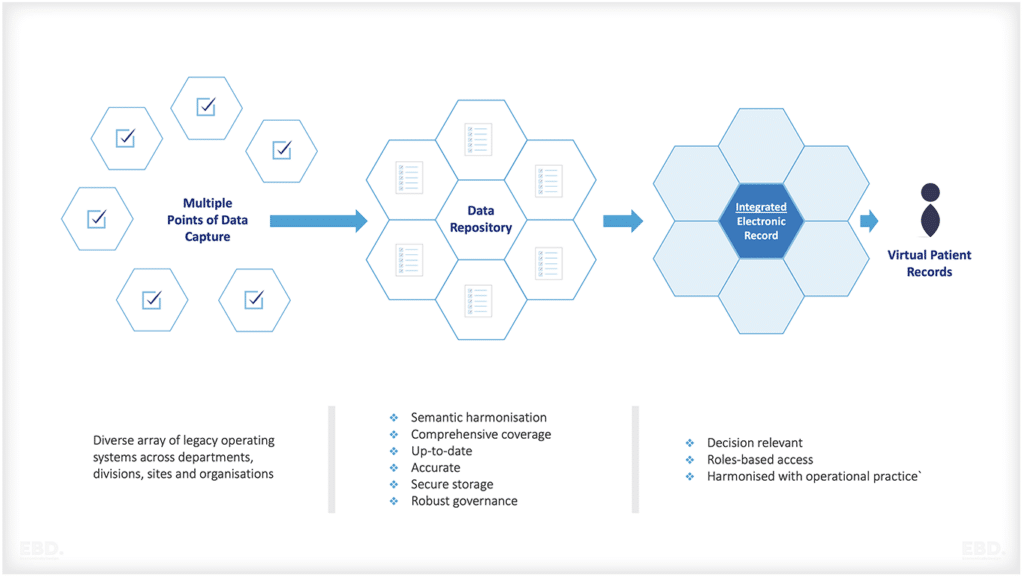
Merkmale einer idealen Datenquelle zur Gewinnung von Erkenntnissen aus der realen Welt
- Die Patientenpopulation ist repräsentativ für die Patienten mit der zugrundeliegenden Erkrankung (z. B. demografische Daten, klinische Komorbiditäten)
- Voraussichtlich Geplant
- Kontinuierliche Aktualisierung mit minimalen Ressourcen
- Längsschnittliche Beobachtung
- Reichhaltige klinische Daten: vom Kliniker eingegeben, vom Patienten gemeldet und vom Patienten erzeugt
- Vorhandene Maßnahmen zur Qualitätskontrolle
- Integriert in bestehende Datensysteme
Es gibt Probleme mit realen Daten. Diese Daten können von unterschiedlicher Qualität sein, was ihre Genauigkeit angeht, und sie können auch nur einen Teil des Bereichs abdecken. Reale Daten sind nicht unbedingt regelmäßig oder zeitnah und liefern möglicherweise nicht in allen Bereichen umfassende Informationen. In dem Maße, in dem die digitalen Fähigkeiten der Gesundheitssysteme ausgereift sind, stellen diese Probleme jedoch immer weniger ein Hindernis für die Nutzung von Daten aus der realen Welt durch die Forschungs- und Entwicklungsgemeinschaft dar.
Was ist Forschungs-Governance?
Forschung und Entwicklung im Gesundheitswesen werfen viele ethische Fragen auf. Forschungsteilnehmer werden gebeten, menschliche Prüfstände für neue Produkte und Dienstleistungen zu sein, die möglicherweise nicht funktionieren oder, schlimmer noch, schaden können. Oft werden sie gebeten, an der Forschung teilzunehmen, weil sie bereits mit einem Leiden oder einer Krankheit leben. Außerdem werden sie gebeten, einem Forschungsteam sehr persönliche Daten und Informationen zur Verfügung zu stellen.
Forschungsmanagement wird definiert als die Vorschriften, Regeln, Grundsätze und Standards, die eine qualitativ hochwertige Forschung gewährleisten und sicherstellen. Eine gut konzipierte Forschungsleitung sollte allen Beteiligten die Gewissheit geben, dass die Forschung nach den erforderlichen Qualitätsstandards durchgeführt wird, dass sie einen Zweck und einen Wert hat und dass die Standards für die Teilnahme, den Schutz von Teilnehmern und Forschern und die gemeinsame Nutzung von Informationen eingehalten werden.
Sie sollte auch die Überwachung der Leistung und den Austausch bewährter Verfahren in der Gesundheitsversorgung ermöglichen. Die Forschungs-Governance erstreckt sich auf alle gesundheitsbezogenen Forschungsarbeiten, die Menschen, ihr Gewebe oder ihre Daten betreffen.
Die Regelungen zur Steuerung der Forschung sind weltweit unterschiedlich. In einigen Ländern gibt es strenge Regelungen, und es ist eine Genehmigung für alle Forschungsarbeiten erforderlich, bei denen Menschen, ihr Gewebe oder ihre Daten verwendet werden. Die ethische Genehmigung hängt von der Qualität des Forschungsprotokolls und der Einwilligung der Teilnehmer ab.
In einigen Ländern gibt es diese Regelungen noch nicht. Wenn die Forschung in Ländern durchgeführt wird, in denen es kein Forschungsmanagement gibt und/oder in denen keine ethische Genehmigung erteilt wurde, kann es für die Forscher schwierig sein, ihre Forschungsergebnisse in Fachzeitschriften mit Peer-Review zu veröffentlichen.
Nützliche Beispiele für Forschungsregelungen und -organisationen sind unter anderem:
- Die Europäische Verordnung über klinische Prüfungen, die die klinischen Prüfungen in der Europäischen Kommission regelt
- Die NHS Health Research Authority (Gesundheitsforschungsbehörde des NHS ) bietet einen politischen Rahmen für bewährte Verfahren bei der Verwaltung und Durchführung von Forschungen im Gesundheits- und Sozialwesen im Vereinigten Königreich.
- Die ClinRegs-Website des US-amerikanischen National Institute of Allergy and Infectious Diseases (NIAD) bietet länderspezifische Informationen über die Vorschriften für klinische Forschung in ausgewählten Ländern weltweit.
Wie hoch sind die Investitionen in die Gesundheitsforschung und -entwicklung?
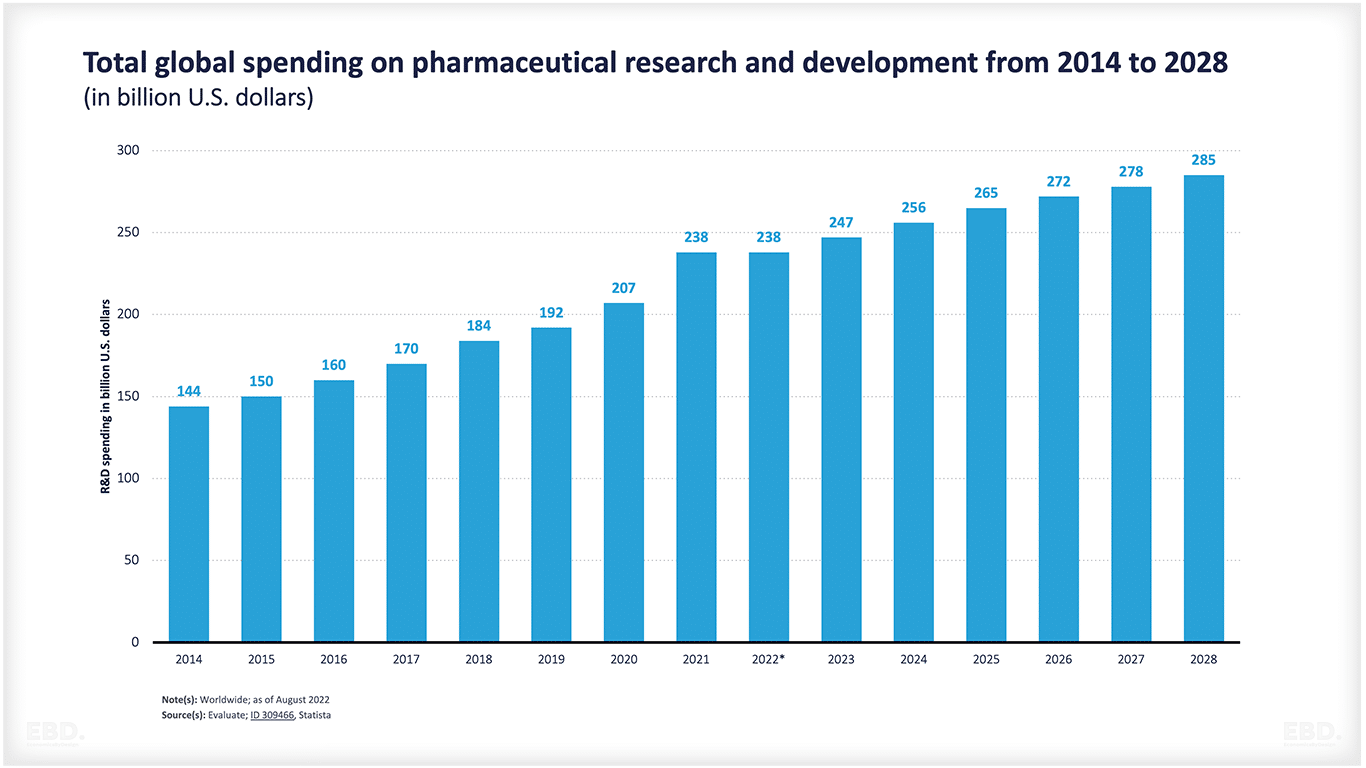
Nach Angaben des UNESCO-Instituts für Statistik gab die Welt im Jahr 2022 umgerechnet 2,47 Mrd. USD für Forschung und Entwicklung aus. Davon entfielen 238 Mrd. USD auf die pharmazeutische Forschung und Entwicklung, und dieser Betrag dürfte bis 2028 auf 285 Mrd. USD ansteigen.
Es gibt viele Akteure, die an der Finanzierung von Forschung und Entwicklung beteiligt sind, darunter Privatunternehmen (z. B. Pharmaunternehmen, Medizintechnikunternehmen, Unternehmen im Bereich der digitalen Gesundheit), die Regierung durch die Gewährung von Zuschüssen und Preisen sowie durch die Unterbringung von Forschung bei staatlichen Gesundheitsdienstleistern und Wohltätigkeitsorganisationen für medizinische Forschung.
Beispiele für weltweit führende Pharmaunternehmen, die in Forschung und Entwicklung investieren, sind:
Zu den weltweit wichtigsten philanthropischen Geldgebern für die Gesundheitsforschung gehören:
- Wellcome Trust
- Howard Hughes Medical Institute
- Bill und Melinda Gates Stiftung
- Institut Pasteur
- Oswaldo Cruz Stiftung
- Rockefeller-Stiftung
Wer betreibt Gesundheitsforschung und -entwicklung?
Der größte Teil der Gesundheitsforschung und -entwicklung wird von klinischen Akademikern, von Klinikern, die von Forschungsförderern finanziert werden, und von akademischen Gesundheitsdienstleistern, die die Forschung aufnehmen, durchgeführt.
Akademische Zentren für Gesundheitswissenschaften sind Gesundheitsdienstleister, die Forschung, Lehre und Leistungserbringung miteinander verbinden. Beispiele hierfür sind:
- Johns Hopkins (School of Public Health, School of Nursing, School of Medicine) in den USA
- UCL-Partner inEngland
- Npistanbul Brain Hospitalin der Türkei
- Medizinisches Zentrum der Universität Leiden in den Niederlanden
Welchen Wert hat die staatlich finanzierte Gesundheitsforschung und -entwicklung?
Die Regierungen finanzieren Forschung und Entwicklung im Gesundheitswesen, um Investitionen aus dem philanthropischen und kommerziellen Sektor anzuregen und den Zugang zu Mitteln in Bereichen zu ermöglichen, in denen die kommerziellen Anreize relativ gering sind.
Die staatlich finanzierte Gesundheitsforschung und -entwicklung kann daher einen Mehrwert schaffen, indem sie sowohl das Wirtschaftswachstum anregt als auch die Verbesserung der Gesundheit der Bevölkerung und des Einzelnen unterstützt.
Es gibt nur sehr wenige Untersuchungen, die zeigen, wie sich die staatliche Finanzierung von Forschung und Entwicklung auszahlt, aber einige Studien haben für ausgewählte Fallstudien positive Ergebnisse gezeigt.
- Grant J, Buxton MJ Economic returns to medical research funding BMJ Open 2018;8:e022131. doi: 10.1136/bmjopen-2018-022131 zeigte Renditen zwischen 7 % und 10 % in Bezug auf den Gesundheitsgewinn und weitere 15 % aufgrund der breiteren wirtschaftlichen Auswirkungen. Grundlage hierfür waren Investitionen in die Herz-Kreislauf-, Krebs- und Muskel-Skelett-Forschung im Vereinigten Königreich.
- Joyce Craig und Kollegen von der University of York schätzten die Rentabilität der Finanzierung von biomedizinischen Forschungszentren im Vereinigten Königreich auf etwa 29 %.
- Eine kürzlich durchgeführte Studie eines Konsortiums aus dem Kings College London, RAND Europe und der Brunel University geht von einer Investitionsrendite von rund 25 % aus (basierend auf der Erforschung von Muskel-Skelett-Erkrankungen im Vereinigten Königreich).
Der wichtigste Faktor, der bei der Betrachtung des Investitionswerts von Forschung und Entwicklung im Gesundheitswesen zu berücksichtigen ist, ist die Tatsache, dass sie von Natur aus unsicher ist. Hier müssen die Gesundheitssysteme bereit sein, Risiken einzugehen, und/oder Unternehmen unterstützen, die bereit sind, Risiken einzugehen.
Globales Observatorium für Forschung und Entwicklung im Gesundheitswesen
Eine der besten Quellen für Informationen über die globale Gesundheitsforschung und -entwicklung ist das Global Observatory on Health R&D der Weltgesundheitsorganisation. Es bietet Informationen und Analysen auf der Grundlage einer Synthese von Daten und Informationen aus der ganzen Welt über Forschung und Entwicklung von Krankheiten.
Es ist eine wirklich reichhaltige Quelle für alle, die herausfinden wollen, was erforscht wird und wo Lücken bestehen. Es ist eine zentrale Anlaufstelle für Forscher auf diesem Gebiet.